作者:微生态
编译:微科盟中元,编辑:微科盟茗溪、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
人类肠道中有胆汁酸7α-去羟基细菌,通过bai操纵子编码的酶从宿主来源的胆汁酸中产生次级胆汁酸,如脱氧胆酸(DCA)。虽然最近的宏基因组研究表明,这些细菌是高度多样化和丰富的,但DCA生产者很少被确认。本文研究了20世纪80年代从人类粪便中分离的DCA产生菌Eubacterium sp. c-25的生理特性,并测定了其全基因组序列。培养实验表明,DCA的生长和生产均偏向于中性和偏碱性。基因组分析表明,c-25在系统发育上与已知的DCA产生者不同,其预测胆汁酸诱导(bai)基因的多簇排列与典型的胆汁酸诱导(bai)操纵子结构有很大不同。这种排列在其他肠道细菌物种中也发现,可能表明7α-去羟基化的能力尚未证实。在胆酸底物存在下,诱导baiB、baiCD和baiH的表达支持了预测bai基因的功能。总之,Eubacterium sp. c-25是一种非典型DCA产生菌,它具有一种新的bai基因簇结构,可能代表了人类肠道中DCA产生者未被探索的基因型。
论文ID
原名:Comparative Genomic and Physiological Analysis against Clostridium scindens Reveals Eubacterium sp. c-25 as an Atypical Deoxycholic Acid Producer of the Human Gut Microbiota
译名:对梭状芽胞杆菌的比较基因组和生理分析揭示Eubacterium sp. c-25是人类肠道微生物群非典型脱氧胆酸的产生者
期刊:Microorganisms
IF:4.128
发表时间:2021.10.29
通讯作者:Satoru Fukiya
通讯作者单位:日本北海道大学
DOI号:10.3390/microorganisms9112254
实验设计

结果
1 形态学
从6 h c-25培养物中,收获对应于指数生长阶段的细胞用于扫描电镜观察。在以前的一份报告中,观察到c-25以单一的杆菌状细胞或2-3个细胞短链的形式存在。然而,我们观察到c-25细胞形成长的、端点与端点相连接、无分支的细丝的单细胞形态,这种形态极其罕见(图2)。由于这些结构特征,细胞边界有时难以划定。大多数节段长度为1-2 μm,少数异常段可达8 μm。
几乎每个细胞都有横向排列的表面结构,通常形成环状图案(图2a,箭头)。鞭毛和纤毛不可见。在一些细胞链的末端也发现了大的、大致呈球形的结构(图2c,箭头)。
在12小时(图2c)和24小时(未显示)分别对应于指数后期和生长平稳期的时间点观察到的细胞c-25形态无明显差异。
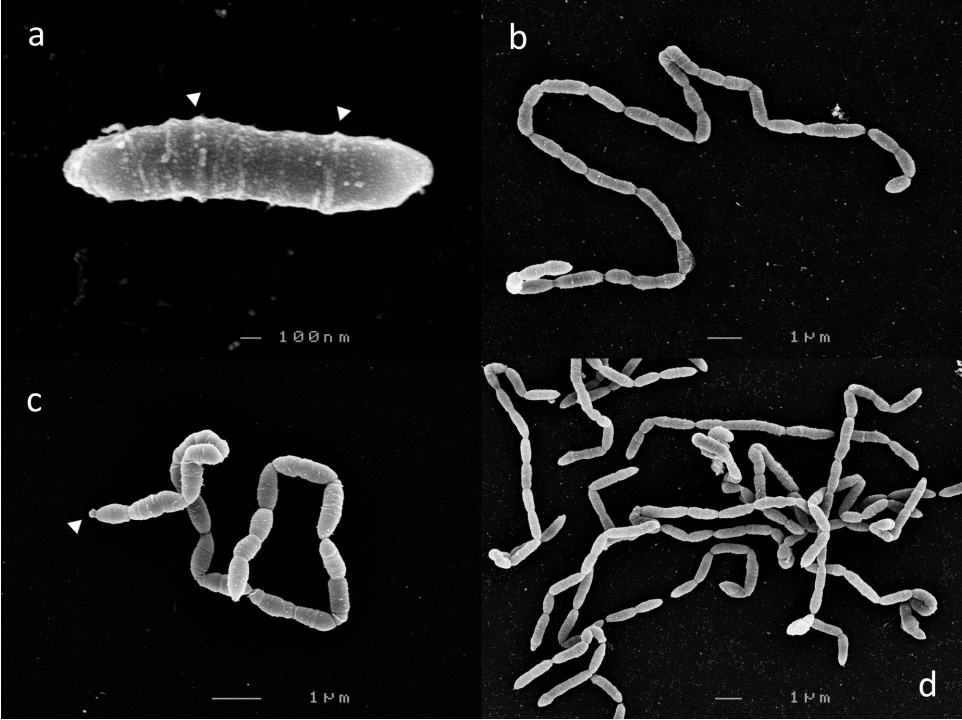
图2 Eubacterium sp. c-25的扫描电镜图。形态学观察状态:(a)单细胞,(b,c)丝状的,(d)缠结丝状。可见细胞外结构为白色箭头所示。图中显示的图像是生长6小时(a,b,d)或12小时(c)后拍摄的。
2 生长和胆汁酸产量
通过一系列培养实验,比较了Eubacterium sp. c-25与C. scindens菌株G10和ATCC 35704T的生长和DCA产量。值得关注的一点是c-25在不同pH条件下生长和产生DCA的能力,因为研究表明胃肠道pH沿肠道长度高度变化,并受到各种生理因素的影响。根据当地环境的理化性质,不同胃肠道区域微生物群落的组成是不同的。此外,早期使用洗净的全细胞进行的研究发现,c-25和C. scindens菌株VPI 12708的7α-去羟基化酶活性的最佳pH值分别为7.3-7.7和7.0,这为研究pH值对体外培养代谢活性DCA产生的影响提供了依据。为此,将培养基pH调整为初始pH 6,7,8或9(±0.15),并使用pH为7的预培养物进行接种。在48小时内测量了生长和胆汁酸产量。培养基没有进行缓冲,因为初步数据显示,当存在几种经测试的有机缓冲液时,c-25的生长明显下降(数据未显示)。因此,培养基pH值的调节导致了短暂的初始pH值,由于二氧化碳和酸性细菌代谢物共同形成碳酸,初始pH值随着时间的推移缓慢下降。测定每种培养基的初始和最终培养基pH值,见表S3。 在每个样本中分析的胆汁酸是CA、DCA和7-oxo-DCA,因为这是在含CA的c-25培养物对31种胆汁酸进行初始胆汁酸筛选时检测到的唯一胆汁酸(数据未显示)。7-oxo-DCA由CA通过7α-羟基甾体脱氢酶催化的可逆反应生成。因此,CA、DCA和7-oxo-DCA被解释为与CA代谢相关的总胆汁酸定量相关池。 据报道,已知的DCA生产者具有不同程度的7α-去羟基化能力,其中C. scindens表现出特别高的活性,比其他菌株高出约100倍。我们的测试结果似乎与这些报道一致(图3a-h)。在pH值为7和8时,G10和ATCC 35704T的DCA增加最快,CA下降最快。在这两种pH条件下,CA的相对水平在2-6 h内迅速下降,符合指数前期到指数中期的生长阶段。这种下降伴随着DCA的相应增加,DCA在胆汁酸池的80-90%处趋于稳定。在DCA初始峰值后,7-oxo-DCA在胆汁液池中保持恒定的5-10%。虽然在pH为6和9的条件下也能观察到生长和DCA的形成,但生长速率较低,CA到DCA的转换延迟。有趣的是,G10在pH值为9时比pH值为6时更有利于DCA的形成,而ATCC 35704T则相反。DCA的形成与细胞密度并非必然相关,pH值为6的两株C. scindens菌株在生长早期低OD660条件下均表现出相当高的DCA形成。总的来说,DCA和7-oxo-DCA的检测,以及CA的几乎完全去除,证实了两株菌株的7α-去羟基化和7α-羟类固醇脱氢酶活性的变化。 在所有条件下,c-25培养物的OD660均显著降低,其峰值为0.374,而G10和ATCC 35704T的OD660分别为1.310和1.133(图3i-l)。菌株在pH值8时生长最快,OD660峰值最高。在pH值为7和8的条件下,48 h内c-25胆汁酸产量显示CA含量稳定下降,DCA和7-oxo-DCA含量相应增加。然而,转化率远远低于C. scindens菌株,约36 h 70-80%的CA底物代谢。在pH值为8的条件下,DCA生成量最高,在36到48 h的孵育后,DCA的水平继续增加近50%。值得注意的是,在pH值为7和8时,总胆汁酸池中7-oxo-DCA的比例也远远高于C. scindens菌株。这在pH值为7时尤其明显,7-oxo-DCA水平超过36 h的DCA。有趣的是,在pH值为6时,没有生长或CA转换的迹象。在pH为9时,虽然培养物显示出明显的生长,但没有观察到DCA的产生,唯一的证据是12小时后胆汁酸转化为7-oxo-DCA。 在最适生长条件方面,C. scindens ATCC 35704T、C. scindens G10和Eubacterium sp. C. 25更倾向于中性条件,而不是弱碱性条件,即pH值为7和8。这些也是诱导DCA快速产生的条件。然而,DCA的产生者对7α-去羟基CA的能力似乎与其生长和增殖能力是分开的。在pH值为6和9的G10和ATCC 35704T培养液中(图3a,d,e,h),细胞密度和DCA的产生并不直接相关,可能是由于酶活性的差异或诱导的bai基因表达。这在c-25中尤其明显,在pH值为8时DCA的形成高于pH值为7时,但在pH值为9时没有检测到DCA,尽管观察到适度的生长(图3j-l)。
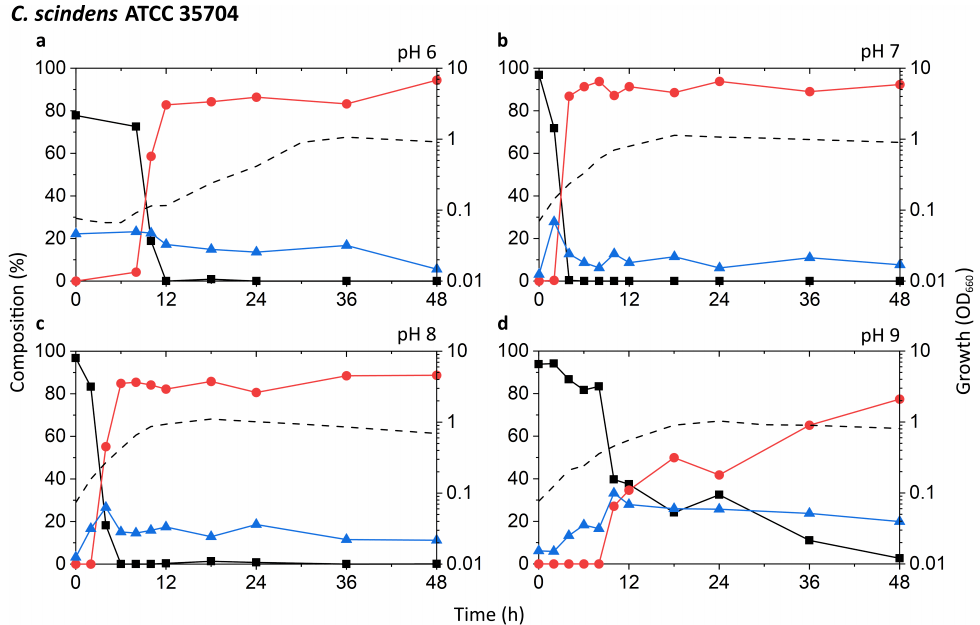
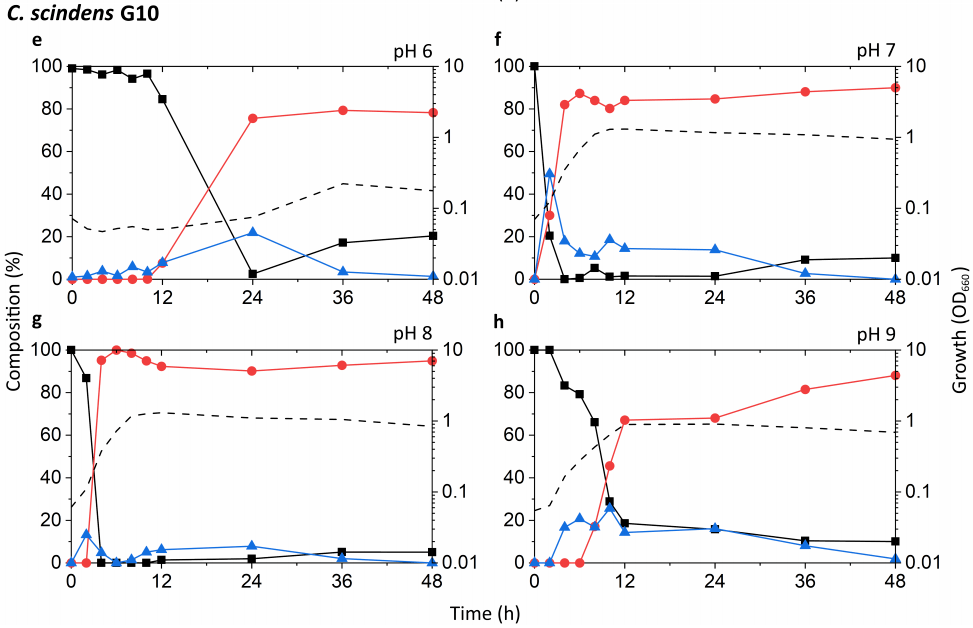
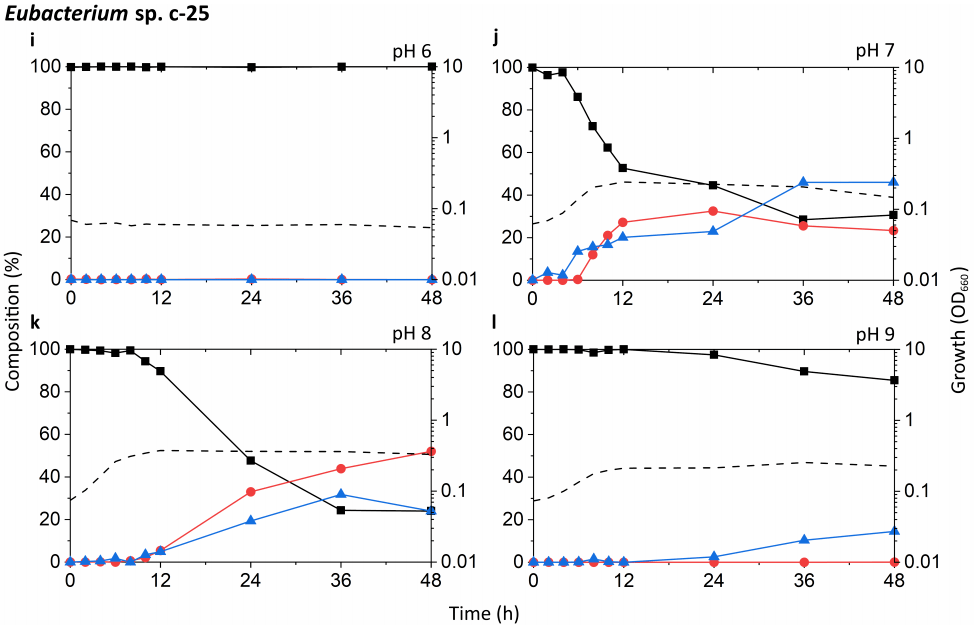
图3 不同初始pH条件下,包括Eubacterium sp. c-25在内的DCA生产者的生长和胆汁酸产量的时间过程分析。试验菌株为:(a-d) C. scindens ATCC 35704T, (e-h) C. scindens G10和(i-l) Eubacterium sp. c-25。生长用OD660(虚线)测定。胆汁酸的百分比是由胆汁酸的浓度相对于CA(黑色方块)、DCA(红色圆圈)和7-oxo-DCA(蓝色三角形)的总浓度来计算的。给出了三个独立实验的平均值。
3 全基因组测序和菌株鉴定
为了在利用基因组序列信息进行系统发育分析的基础上对c-25进行分类鉴定,我们与C. scindens G10一起确定了c-25的全基因组序列,该全基因组序列也缺乏基因组信息,可用于与c-25的基因组比较分析(表2)。利用新获得的基因组数据,对c-25 16S rDNA序列进行BLASTn搜索,以寻找近缘物种。有趣的是,最接近的匹配是Lachnoclostridium phocaeense,一种从人类尿液中分离出来的细菌,其序列一致性为97.2%。 虽然这已经低于建议的物种划分阈值~ 98-99%,但我们还进行了ANI分析,更确定地区分c-25和L. phocaeense(图4)。结果显示,c-25的ANI值只有74.9%,远低于普遍接受的95%种内截断值,我们认为c-25与L. phocaeense不是同一种。此外,与表1所列的其他DCA生产者相比,观察到更低的ANI值(64.65%至71.82%),表明至少在物种水平上,c-25在它们之间的系统发育唯一性。C. scindens G10也表现出与其他DCA菌株相似的ANI值(64.66% ~ 73.75%),但与C. scindens ATCC 35704T的匹配度为99.35%,证实其为C. scindens菌株。 为了研究c-25的系统发育和更高层次的分类,利用来自c-25 16S rDNA序列的前29个BLASTn片段,以及来自其他DCA生产者(C. scindens ATCC 35704T、C. scindens G10和Peptacetobacter hiranonis)的16S rDNA序列,构建系统发育树(图5)。根据NCBI分类数据库,我们只纳入了已建立或提议的种级分类名称的菌株。有趣的是,C. hylemonae是唯一出现在前29片段中DCA的生产者。该树还包括后来在研究中发现的新假设的DCA生产者:Sporofaciens musculi, Dorea sp. AM58-8, Dorea sp. AF36-15AT(表1)。最后,从16S rDNA相似性来看,c-25与L. phocaeense的亲缘关系最为密切,而在前BLAST片段中未检测到其他Lachnoclostridum菌株,我们还增加了3株Lachnoclostridium菌株,通过其与Lachnoclostridium属其他成员的系统发育距离来预测c-25是否属于Lachnoclostridium属:Lachnoclostridium edouardi Marseille-P3397 (NZ_OESQ01000006)、Lachnoclostridium pacaense Marseille-P3100 (NZ_LS999944)和Lachnoclostridium phytofermentans ISDg (NC_010001)。因此,共有39株菌株被纳入系统发育树(图5)。 结果表明,Eubacterium sp. c-25与L. phocaeense亲缘关系最为密切,与其他已知DCA产生菌如C. scindens、C. hylemonae和P. hironis有较远的距离。然而,出乎意料的是,其他近亲属并不包括额外的Lachnoclostridium物种,而是在Eubacteriales目的Drancourtella属, Massilistercora属和Mordavella属。此外,其他Lachnoclostridium物种也不聚集在一起,因为被预期来自同一属成员。这些结果表明,Eubacterium sp. c-25可能是Eubacteriales目中的一员,但由于Lachnoclostridium属的分类地位不明确,在科和属水平上无法进行正确的分类。为了获得c-25的可靠分类信息,需要对其分类学进行重新审查,并对包括L. phocaeense在内的分类单元名称进行有效发表。
表1 用于生物信息学分析的菌株的基因组信息。
1 IMG分类单元的ID。
表2 完整的基因组序列信息。
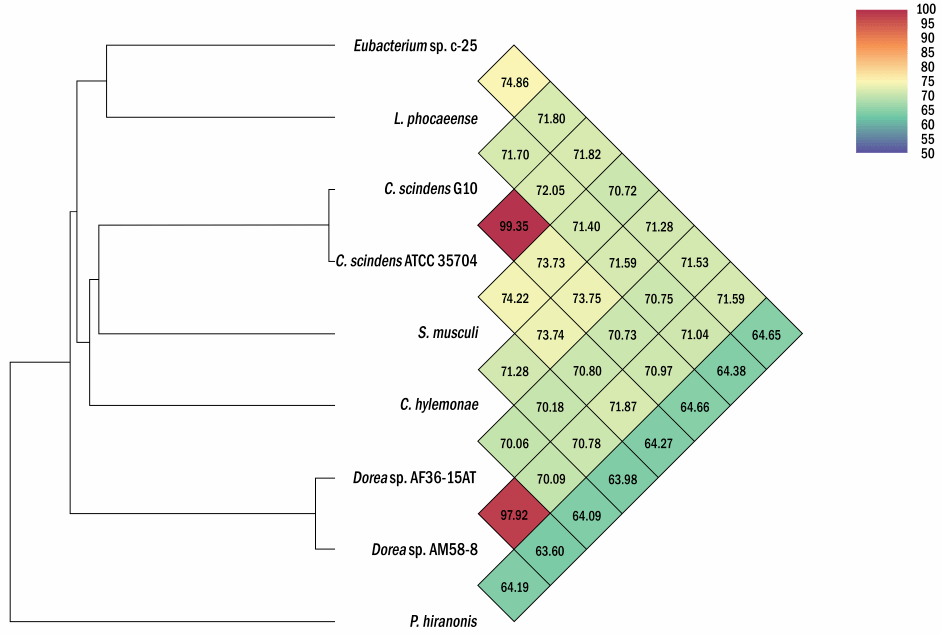
图4 Eubacterium sp. c-25、L. phocaeense和其他与DCA产生相关的菌株之间的ANI热图。使用表1所列菌株进行ANI分析。通过OAT生成热图,并在原始输出的基础上进行高分辨率重构。
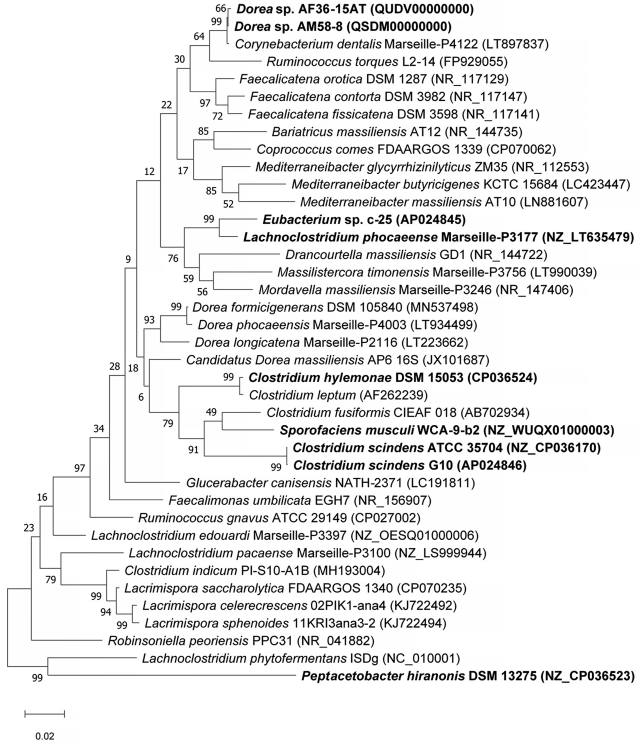
图5 Eubacterium sp. c-25及其相关菌(包括已知DCA产生菌)的最大似然系统发育树。构建树的菌株包括29个与Eubacterium sp. c-25最接近的16S rDNA序列BLASTn(不包括未培养和未识别的菌株)匹配,以及另外10个人工添加的菌株:L. phocaeense Marseille-P3177, C. scindens G10, C. scindens ATCC 35704T, P. hiranonis DSM 13275, S. musculi WCA-9-b2, Dorea sp. AF36-15AT, Dorea sp.AM 58-8, Lachnoclostridium edouardi Marseille-P3397 (NZ_OESQ01000006), Lachnoclostridium pacaense Marseille-P3100 (NZ_LS999944)和Lachnoclostridium phytofermentans ISDg344 (NC_010001)。本研究中用于生物信息学分析的菌株被加粗。树是在MEGA X中使用Tamura-Nei模型构建的,有1000个bootstrap,并在中点生根。bootstrap支持值列在分支的旁边。
4 bai基因的鉴定
全基因组同源基因的分类从c-25和其他DCA生产者使用OrthoFinder允许发现了一组基因,在c-25 (EUBC25_24880-EUBC25_24960, EUBC25_02220)和G10 (CSCING10_002180 CSCING10_002270),被预测为C. scindens ATCC 35704T 同源的bai基因(S1补充文件)。预测的c-25 Bai蛋白与C. scindens ATCC 35704T的蛋白序列相似性低得惊人,但BaiH蛋白除外(图6)。当地BLASTp搜索证实,c-25基因组编码的其他蛋白质与C. scindens ATCC 35704T Bai蛋白的序列相似性大于OrthoFinder发现的蛋白质,这支持了它们作为bai基因同源物的预测。 假设的c-25 bai基因的基因排列与C. scindens有很大差异(图7)。与C.scindens的整个bai基因簇由单个启动子控制并产生单个多顺反子mRNA不同,似乎c-25的bai基因被分离成多个基因簇,这些基因簇可能来自不同的启动子位点(启动子预测信息见表S4)。在c-25中,baiA2BGF和baiCDE分别构成一个基因簇,而baiH和baiI与其他bai基因不共享一个启动子。预测胆汁酸调控元件(barA, barB)被认为参与转录调控的基因被发现在baiA2BGF集群的上游。此外,baiI位于一个单独的染色体区域,远离其他的bai基因。重要的是,在c-25中没有发现baiG同源物。相反,在baiB下游存在一个与C. scindens BaiG转运体相似的MFS转运体基因,但其氨基酸序列一致性较低(22%,E-value 0.013, BLASTp)。我们假设这种类似于baiG的转运蛋白是baiG的功能性同源物。 对C. scindens G10的基因组也进行了同样的分析。这些分析发现了一个与C. scindens ATCC 35704T几乎相同的bai操纵子结构(基因排列与图1b相同,bai蛋白的氨基酸序列约100%相同),与预期的同一物种成员相同。结果证实了C.scindens G10在DCA产量和其7α-去羟基化能力的基因组基础上均属于传统的7α-去羟基化物种。
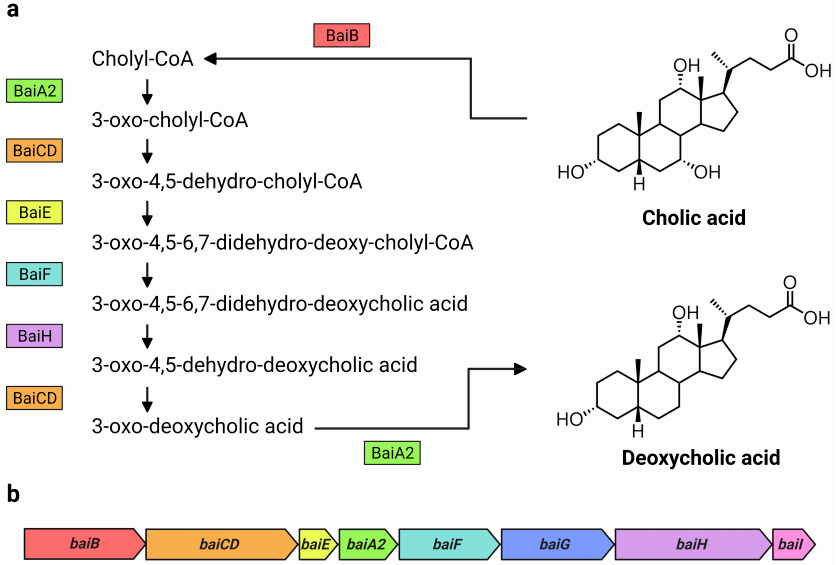
图1 bai蛋白质和bai基因参与了CA形成DCA的过程。(a)Funabashi等人研究了C. scindens VPI 12708中CA和 DCA的7α-去羟基化过程,包括bai蛋白质和中间产物。(b)研究了C. scindens VPI 12708和ATCC 35704T中bai操纵子的排列。bai蛋白在bai操纵子中由它们各自的基因进行颜色编码。
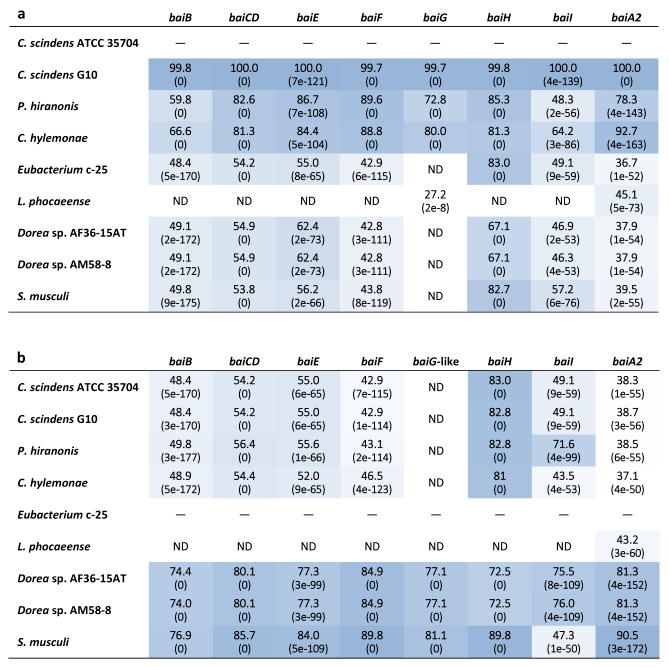
图6 已知和新鉴定的bai基因氨基酸序列识别热图表,假设的DCA生产者。c-25最接近的亲缘种为L. phocaeense。利用BLASTp分析(a) C. scindens ATCC 35704T和(b) Eubacterium sp. c-25参考bai基因作为查询,评估氨基酸序列的同源性(%)。BLAST期望值(E-values)在括号中给出。较暗的方框表示较高程度的序列一致。ND =未检测到。bai基因标识信息见表S1。
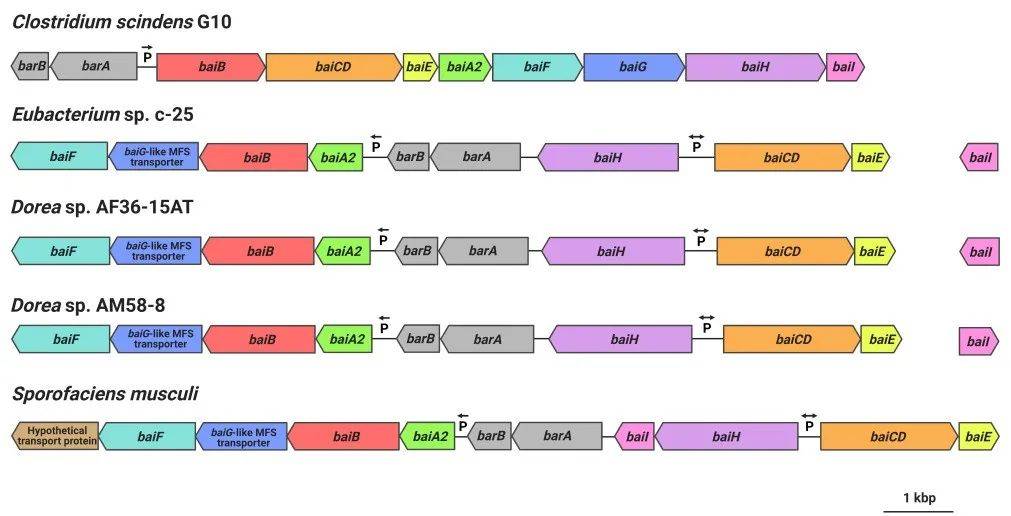
图7 在C. scindens G10, Eubacterium sp. c-25, Dorea sp. AF36-15AT, Dorea sp. AM58-8和S. musculi中观察到的bai基因排列。共享基因(或预测的功能同系物在baiG的情况下)是彩色编码的。
5 CA存在下bai基因的表达分析
由于成功地在Eubacterium sp. c-25中鉴定出了bai候选基因,我们利用baiB、baiCD和baiH的特异性引物进行了qRT-PCR分析。本分析的目的是通过检测CA在C. scinden中的诱导表达水平来验证假设的bai基因的身份,并将每个基因的表达水平与C. scindens G10中的表达水平进行比较。值得注意的是,在CA缺失的情况下,C. scindens ATCC 35704T中的bai基因在基础水平上被转录,而且可以下调到更低的表达水平。我们预计baiB、baiCD和baiH的相对基因表达水平在G10中是相似的,在G10中它们是从单个启动子位点转录的,而在c-25中它们的相同基因表达水平则显示更多的差异。选择这些bai基因是因为它们代表了c-25中三个主要的bai基因簇,并且也被报道为7α-去羟基化所必需的。此外,baiB是C. sciindens bai操纵子中第一个转录的基因,baiH是倒数第二个转录的基因,覆盖了整个bai操纵子。 qRT-PCR结果显示,在CA存在的情况下,G10中baiB、baiCD和baiH的bai基因表达分别增加了67.3倍、29.8倍和16.6倍(图8a和表S5)。在c-25中,这些基因的表达增加了218.8、291.8和13.9倍(图8b和表S6),表明预测的bai基因同源物在c-25中是功能性bai基因。然而,bai基因在c-25中的表达水平有相当大的差异,baiB和baiCD的表达水平大约是baiH的15倍20倍。在G10中,bai基因表达水平相对相似,并且如预期的那样,在操纵子中按下游顺序下降。
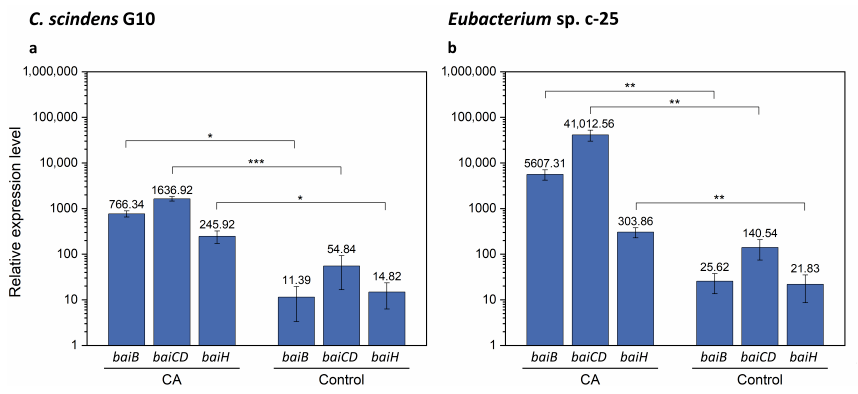
图8 qRT-PCR结果显示,添加或不添加CA时,baiB、baiCD和baiH基因的表达。表达测量(a)C. scindens G10 (n = 3)和(b)Eubacterium sp. c-25 (n = 7)。细胞在调节pH值为8的GAM 中培养,在存在(CA)或不存在(对照)0.1 mM CA的情况下收集并在指数中期生长阶段进行总RNA提取。给出了每个基因相对于参考管家基因recA的表达水平的平均值。误差棒表示平均值的标准误差。p值低于0.05被认为是显著的,并在面板中用星号表示(*:p <0.05, **: p<0.01,***: p<0.001)。
6 7α-去羟基细菌的鉴定
最后,我们寻找其他可能具有与c-25相似的bai基因结构和排列的细菌。由于在c-25中发现Bai蛋白序列与传统DCA生产者有很大的不同,我们使用c-25中的BaiB进行了微生物蛋白BLAST搜索。通过对分离菌株和测序菌株进行筛选,发现3株菌株与c-25 BaiB基因相似度为74-77%:Sporofaciens musculi、Dorea sp. AF36-15AT和Dorea sp. AM58-8。各品系均证实存在其他bai基因。这三种菌株的bai基因排列与c-25几乎相同(图7),只是在S. musculi中,在baiA2-F操纵子的下游端额外编码了一个转运体基因,baiI基因位于baiH的下游。在c-25中发现的像baiG的转运蛋白也在这三个新的候选菌株中类似位置发现(图7)。
讨论
本研究明确了独特但被遗忘的次级胆汁酸产生菌Eubacterium sp. c-25的形态、生长、胆汁酸代谢和基因组信息。长期以来,已知肠道DCA产生者的名单一直局限于少数几种物种,在几十年的研究中,几乎没有发现新的分离物。此外,目前的DCA形成模型主要基于C. scindens研究收集的数据。而人类粪便分离Eubacterium sp. c-25已被证实能产生DCA,但在本研究中获得的生理和基因组数据挑战了当前DCA生产者的认识,揭示了其独特的形态(图2),依赖于特定的pH值最佳生长条件和7α-去羟基化(图3),以及一种新的bai基因排列,这可能代表了DCA产生者中完全未被探索的基因型,其存在多个系统发育上遥远的肠道/粪便分离株:S. musculi、Dorea sp. AF36-15AT和Dorea sp. AM58-8(图6和7)。
在其他DCA生产中未观察到c-25的丝状形态。C. scindens、P. hiranonis和C.hylemonae的图像显示它们具有相似的杆状形状,但任何可见的端到端连接仅限于两个或三个细胞链。在各种肠道细菌中都可以观察到丝状形态,包括乳酸菌和双歧杆菌,但对于丝状梭菌的报道很少,因为它们主要是不相连的。这进一步支持了我们的发现,即c-25在系统发育上不同于已知的DCA生产者。
16S rDNA系统发育分析结果表明,从分类上看,c-25属于Eubacteriales目(图5)。然而,由于其最近亲缘物种L. phocaeense的分类命名存在问题,目前Lachnoclostridium分类方案中,很难正确分类c-25。
从图3中可以看出,包括c-25在内的所有被试菌株的生长和DCA的产生在很大程度上依赖于培养基的pH。一个有利于体外生长和7α-去羟基化的pH范围可能暗示了胃肠道环境中的定殖偏好。C. scindens似乎能够在较宽的pH范围内增殖,而c-25可能局限于中性或微碱性环境。窄的pH范围可能有利于该菌株在c-25范围内生长,限制该菌株向具有较高pH值的特定个体或胃肠道截面的生长。例如,尽管不同研究的结果和测试方法不同,但似乎有一个普遍的共识,即近端结肠pH值范围约5.8-6.7左右,在远端结肠和直肠中则上升到6.1-7.5。克罗恩病(Crohn’s disease)和溃疡性结肠炎患者的胃肠道pH值也出现升高。虽然c-25在人类肠道中的流行率尚不清楚,但有可能该菌株占据了一个特定的生态位,如远端结肠,或者在不规则的生理条件下大量存在,导致肠道pH值增加,这表明pH值可能被用作与DCA产量增加相关的疾病状态的标记。近年来,虽然生理pH值与定殖之间的联系尚未得到专门研究,但利用纳米级二次离子质谱和宏蛋白质组学分析对接种的C. scindens在灵生小鼠模型中的定位特异性定殖进行了研究。为了进一步研究c-25和其他DCA生产者的生态位,有必要引入这些先进的技术,并专门针对肠道pH随位置和个体的变化进行研究。
长期以来,7α-去羟基化的需要是诱导baiA2-I基因簇,该基因簇由单个启动子控制并产生单个多顺反子mRNA。虽然最近发表的一项宏基因组组装基因组分析发现,bai基因簇的不同排列与C. scindens中发现的排列不同,但还没有菌株被实验证明能够产生DCA。在c-25中发现了独特排列但具有明显功能的bai基因簇,以及它在其他细菌中的存在,需要重新检查DCA生产者的多样性和7α-去羟基化的遗传基础。如图8所示,c-25在CA存在时,baiB和baiCD的表达显著增加,相比之下,CA诱导的baiH表达量增加不大。这种不成比例的诱导与c-25 bai基因被分成多个单独转录的基因簇的事实相一致,但提出了bai基因表达在c-25中如何协调和调控的问题。这些高表达bai基因的生理和代谢影响需要进一步研究,这可能有助于深入了解影响DCA在胃肠道环境中形成的因素。
通过对c-25和C. scindens的bai基因的比较分析,提出了其功能和保存的几个问题。首先,虽然我们假设像BaiG蛋白是胆酸转运蛋白BaiG的功能性同源物,但这还有待实验证实。由于它与C. scindens的BaiG蛋白只有22%的氨基酸序列相同,因此在蛋白质结构和生物功能上可能存在较大差异。其次,baiI被认为编码了7β-脱水酶,参与熊胆酸(具有7β-羟基的CA的外分子)的7β-去羟基化成DCA,在先前分析的DCA产生物的bai操纵子中发现,该基因并没有与c-25中的其他bai基因或两个Dorea种与c-25有着相同bai基因排列。由于baiI实际上已经被证明在体外对7α-去羟基化没有必要,有可能只有当底物具有7β-羟基时,baiI在c-25和两种Dorea物种中才有差异表达。第三,与其他bai基因相比,c-25和C.scindens中的baiH具有很高的相似性(图6),说明它在7α-去羟基化过程中具有重要作用,是一种不可替代的蛋白。最近的一项研究表明,在宏基因组数据集鉴定的同源基因中,baiH及其同源基因baiCD的蛋白质序列似乎比其他bai基因保守程度更高,但在本研究中,c-25的baiCD序列一致性不高。c-25中其余的白族基因均表现出低蛋白质序列相似性,同源率约为50%(图6)。由于7α-去羟基化酶级联的每一步都需要复杂的生化修饰,我们期望DCA生产者具有更高程度的bai基因守恒。然而,在c-25和C.scindens之间观察到的低蛋白质相似性,以及可能由不同的基因安排导致的不同水平的差异表达,表明DCA生产者之间的基因型变异性可能比之前预期的更多。
在Eubacterium c-25中发现的独特的bai基因排列在其他细菌(如S. musculis 和 Dorea spp.)中发现,这一观察有力地证明了肠道DCA产生者中存在替代bai基因型。大规模宏基因组分析表明,bai基因在肠道微生物群落中比之前认为的更常见,这就提出了一个问题,即除了迄今发现的少数DCA生产者之外,还对其实际数量和多样性提出了质疑。
转自:微生态- 本文固定链接: https://www.maimengkong.com/kyjc/1449.html
- 转载请注明: : 萌小白 2023年4月16日 于 卖萌控的博客 发表
- 百度已收录
