一、实验原理
利用荧光素酶与底物结合发生化学发光反应的特性,把感兴趣的基因转录的调控元件克隆在萤火虫荧光素酶基因(firefly luciferase)的上游, 构建成荧光素酶报告质粒。然后转染细胞,适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶活性的高低判断刺激前后或不同刺激对感兴趣的调控元件的影响。
同时,为了减少内在的变化因素,比如:培养细胞的数目、细胞转染和裂解的效率等对实验准确性的影响,将带有海肾荧光素酶基因(Rinilla luciferase)的质粒(phRL-TK)作为对照质粒与报告基因质粒共转染细胞,提供转录效率的内对照,使测试结果不受实验条件变化的干扰。
在测量过程中,首先加入荧光素酶检测试剂Luciferase Assay Reagent II时产生萤火虫荧光信号,这样先测量萤火虫荧光素酶活性。定量萤火虫荧光强度之后,再在同一样品中加入Stop&Glo Reagent试剂,将上述反应淬灭,并同时启动海肾荧光素酶反应,进行第二次测量,称之为双荧光素酶报告基因实验。
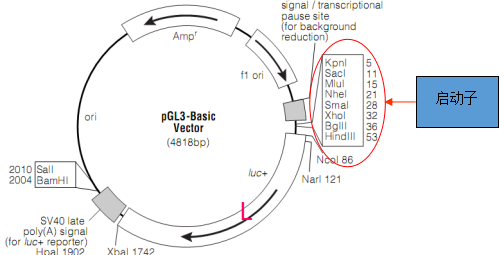
二、应用简介
双荧光素酶实验通常用于以下研究方向:验证miR同mRNA靶向互作。将待测mRNA的预测靶向序列插入报告基因载体,再共转入该miR mimics,如果荧光素酶活性下降,则提示为其靶序列。验证miR同lncRNA靶向互作。将候选的lncRNA预测靶向序列插入报告基因载体中F-Luc的3’UTR区域,检测荧光素活性。启动子结构分析。将启动子区域序列(通常2k左右)进行分段截短,或对特定位点进行突变,再分别构建入luciferase报告载体中替换启动子序列,检测其启动子活性。验证特定转录因子同其调控序列的作用。将该序列(通常为启动子区域)插入报告基因载体,同时在实验细胞中共转过表达该转录因子,可分析转录因子过表达是否提高荧光素酶活性。
报告基因(reporter gene):是一种编码可被检测的蛋白质或酶的基因,也就是说,是一个其表达产物非常容易被鉴定的基因。
一般的,把报告基因的编码序列和基因表达调节序列相融合形成嵌合基因,或与其它目的基因相融合,从而利用它的表达产物来标定目的基因的表达调控。
在动物基因表达调控的研究中,报告基因被广泛应用。如绿色荧光蛋白(GFP)和荧光素酶。
荧光素酶(Luciferase):是能够催化不同底物氧化发光的一类酶的统称,哺乳细胞无内源性荧光素酶。
荧光素酶报告基因的优点
1、优越的灵敏度,比Westernbloting灵敏度高1000倍以上;
2、内源性低,哺乳动物无内源性表达;
3、荧光素酶检测不受细胞内其他物质影响;
4、发光检测,检测方便;
5、灵敏度高,10‐20摩尔荧光素酶分子;
6、检测范围广,大于7个数量级。
主要应用领域
1、潜在启动子/启动子核心区域检测;
2、潜在增强子/抑制子等调控子核心元件检测;
3、启动子区可能的转录因子结合位点检测;
4、启动子/增强子与转录因子的相互作用;
5、病毒/细胞相互作用;
6、药物等化学诱导因素对启动子活性的调节(抑制或增强);
7、射线等物理诱导因素对启动子活性的调节(抑制或增强)。
三、 实验方法
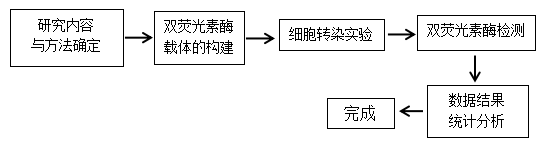
![]()
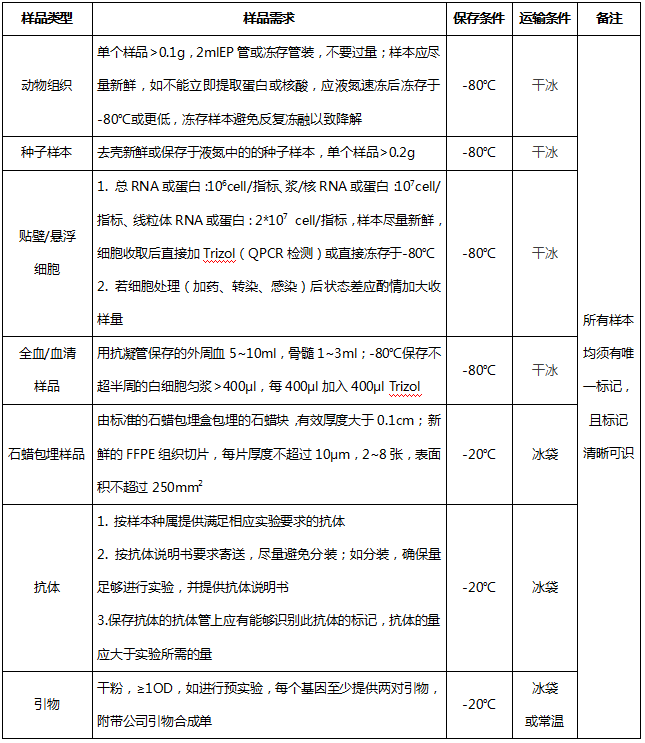
四、样本送检要求
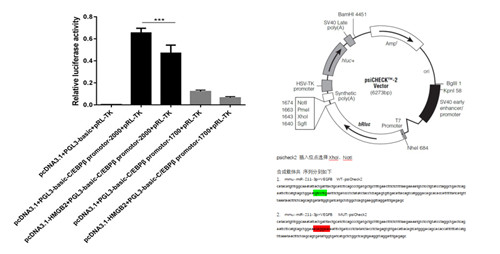
五、案例展示
六、常见问题
1、由于温度对酶反应有影响,所以测定时样品和试剂均需达到室温后再进行测定。
2、Renilla荧光素酶检测工作液后需配制后立即使用,不可配制成工作液后长期保存。
3、Luciferase Assay Reagent II (LAR II)不能反复冻融,保证每次用同一批次的LAR II。配好的LAR II在-20度可稳定一个月,在-70度 可稳定一年。
4、试剂保存和使用时都应避光。
5、为取得最佳测定效果,测定时,样品和测定试剂混合后到测定前的时间应尽量控制在相同时间内(1-2秒)。
6、使用过程中切勿接触操作屏(程序会被终止或取消)。
7、平时尽量不要移动仪器,防止触摸屏走位。
转自:http://www.sciedit.cn/scientific/index/cat_id/72.htm- 本文固定链接: https://www.maimengkong.com/kyjc/1198.html
- 转载请注明: : 萌小白 2022年10月1日 于 卖萌控的博客 发表
- 百度已收录
