传统上,纹状体黑质神经元以促进运动而为人所知,它包含多种具有不同转录组特征的亚型。然而,它们对运动调节的具体作用仍未被完全理解。通过使用基因标记物 Kremen1 和 Calb1,我们在小鼠模型中证明,Kremen1 阳性(Kremen1+)和 Calb1 阳性(Calb1+)的纹状体黑质神经元对运动有着相反的作用。Kremen1 + 神经元在运动开始时激活较晚,但在运动结束时活动增强。相比之下,Calb1 + 神经元在运动开始时激活较早,在运动结束时活动减弱。光遗传学方法激活 Kremen1 + 神经元会抑制正在进行的运动,而激活 Calb1 + 神经元则会促进运动。激活 Kremen1 + 神经元比激活 Calb1 + 神经元能引起多巴胺释放的更大幅度减少,随后会出现刺激后的反弹。相反,激活 Calb1 + 神经元会引发多巴胺释放的最初增加。此外,在 Aldh1a1 阳性的黑质纹状体多巴胺能神经元(DANs)中对 GABA-B 受体 Gabbr1 进行基因敲低,减少了对 DANs 的抑制,并完全消除了 Kremen1 + 神经元对运动的抑制作用。总之,这些发现揭示了纹状体黑质神经元亚型内的一种细胞类型特异性机制:Calb1 + 神经元促进运动,而 Kremen1 + 神经元通过 GABBR1 受体抑制 Aldh1a1+ DANs 的活动来终止正在进行的运动。

东莞富临医疗科技有限公司是LabMaker在中国的代理商,富临医疗为中国客户提供LabMaker微型荧光显微镜与实验室从0到1搭建。
一、引言
纹状体棘状投射神经元(SPNs)约占背侧纹状体神经元总数的 95%,在运动学习、决策制定以及调节自主运动方面起着关键作用。这些 SPNs 可以大致分为两种主要亚型:表达多巴胺受体 D1(Drd1)的直接通路神经元(dSPNs),它们直接投射到苍白球内侧部(GPi)和黑质网状部(SNr);以及表达多巴胺受体 D2(Drd2)的间接通路 SPNs(iSPNs),它们投射到苍白球外侧部(GPe)。dSPNs 主要投射到 SNr,也被称为纹状体黑质神经元。人们普遍认为,dSPNs 促进运动的发起,而 iSPNs 抑制不必要的运动。
SPNs 在背侧纹状体中还可以进一步细分为两个互补的区域,即斑片(或纹体小体)和基质区域,它们以不同的神经化学标记物和输入输出连接为特征。每个区域都包含 dSPNs 和 iSPNs。在啮齿动物中,斑片区域通常以相邻 SPNs 簇中 μ- 阿片受体(MOR1)的表达为标志,而基质区域则以钙结合蛋白(CALB1)的表达为标记。单细胞转录组学的进展已经确定了 dSPNs、iSPNs 以及与斑片和基质相关的 SPNs 的其他基因标记物。有趣的是,尽管斑片标记物主要在斑片区域表达,但一些也存在于单个或小簇的 SPNs 中,这些被称为 “外斑片” 神经元,分散在整个基质区域中。此外,任何给定的斑片标记物通常只标记与斑片相关的 SPNs 的一个子集。先前的研究强调了斑片 SPNs 在调节情绪、决策制定和奖赏处理方面的重要性,而基质 SPNs 则与动作选择有关。然而,分子层面定义的与斑片相关的 dSPNs 在运动控制中的具体作用仍知之甚少。
斑片和基质 dSPNs 都支配位于黑质致密部(SNc)腹侧层的醛脱氢酶 1a1 阳性(Aldh1a1+)多巴胺能神经元(DANs),这些神经元在帕金森病中特别容易发生退化。值得注意的是,一部分与斑片相关的 dSPN 轴突终末会聚集在一起,形成独特的纹体小体 - 树突花束结构,与延伸到 SNr 的 Aldh1a1+ DANs 的树突相互缠绕。这种解剖结构可能是与其他抑制性输入相比,与斑片相关的 dSPNs 对 DANs 产生更强的突触前抑制的基础。此外,正如脑片记录所证明的那样,与斑片相关的 dSPNs 通过 GABA-B 受体对 DAN 神经元活动产生持久的抑制作用,关键地调节了 Aldh1a1 + 黑质纹状体 DANs 从紧张性放电到爆发性放电的转变。尽管有这些认识,但这种独特的纹状体黑质回路的生理和行为意义仍有待探索。
研究与斑片相关的 SPNs 的一个主要挑战是难以确切地表征和操控这些神经元,这在很大程度上是因为它们的神经化学组织结构不太明确。在这项研究中,我们最初确定 Kremen1 基因为背侧纹状体中与斑片相关的 SPNs 的一种特异性分子标记物。随后,我们培育了一种 Kremen12A-Cre 基因敲入(KI)小鼠品系,以研究 Kremen1 阳性(Kremen1+)dSPN 亚群的解剖结构,以及与 Calb1 阳性(Calb1+)基质 dSPNs 相比,它们在运动控制中的功能意义。
二、结果
01. Kremen1 转录本在背侧纹状体的斑片区域富集
利用已发表的斑片报告基因 Nr4a1-eGFP 转基因小鼠,我们通过激光捕获显微切割技术分离出背侧纹状体中含有 eGFP 的组织以及相邻组织,用于进行大量 RNA 测序(NCBI 登录号:PRJNA870469)。与之前检测的各种斑片标记物,如 Oprm1、Tshz1、Pdyn、Nr4a1 和 Sepw1 相比,Kremen1 mRNA 的表达在斑片区域与基质区域之间表现出明显更高的差异(图 1a,b)。一致地,Kremen1 也被一项独立的单细胞核转录组学研究鉴定为一种斑片标记物。通过 RNAscope 原位杂交技术,进一步对 Kremen1 与 Drd1 和 Drd2 进行共定位分析发现,大约 60% 的 Kremen1 + 棘状投射神经元(SPNs)对应于直接通路神经元(dSPNs),而 35% 被鉴定为间接通路神经元(iSPNs),这与纹状体中总 dSPNs 与 iSPNs 的比例相似(图 1c–e)。此外,Kremen1+ SPNs 主要分布在背侧纹状体(图 1f)。在纹状体中,Kremen1+ SPNs 占总 SPNs 的 12.7%,在斑片区域(由五个或更多相邻的 Kremen1+ SPNs 簇定义)的 SPNs 中占 52%,在基质区域的 SPNs 中占 8.2%(图 1g)。值得注意的是,尽管斑片区域中 Kremen1+ SPNs 的总数略低于基质区域,但 Kremen1+ SPNs 在斑片区域的密度明显高于基质区域(图 1h)(图 1i)。这些发现突显了 Kremen1 是一种有用的基因标记物,可用于识别 SPNs 的一个独特亚群,其中一部分在背侧纹状体中专门形成类似斑片的簇。
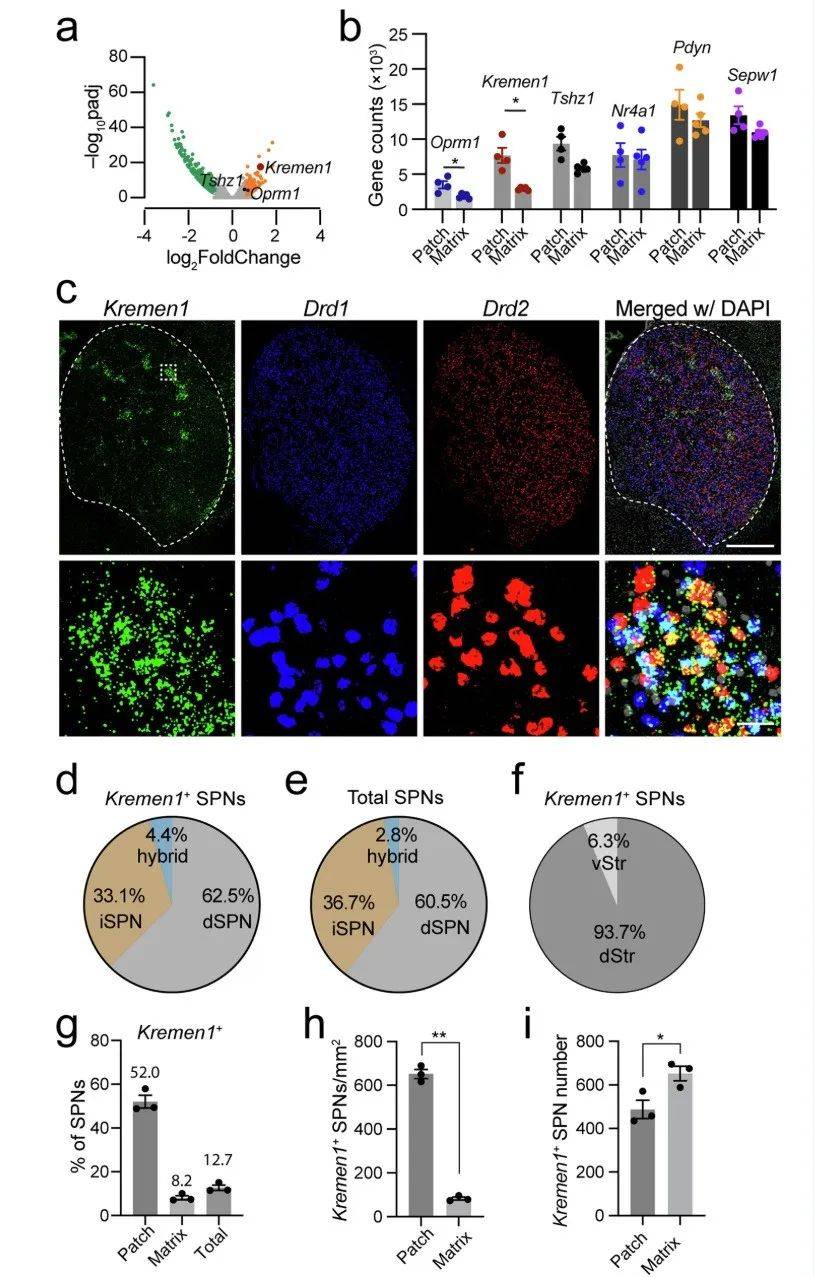
图 1:Kremen1+ SPNs 在斑片和基质区域的分布。a 火山图显示了斑片(n = 4 只小鼠)和基质(n = 5 只小鼠)区域的差异基因表达,其中 Kremen1、Oprm1 和 Tshz1 在斑片神经元中富集。b 散点图比较了斑片(n = 4 只小鼠)和基质(n = 5 只小鼠)区域中选择性基因的表达水平。数据以平均值 ± 标准误表示。配对 t 检验,双尾,Oprm1:*p = 0.0406;Kremen1:*p = 0.0218;Tshz1:p = 0.0693;Nr4a1:p = 0.8132;Pdyn:p = 0.5581;Sepw1:p = 0.1182。c 纹状体中 Kremen1、Drd1、Drd2 和 DAPI 的 RNAscope 代表性共聚焦图像。底部是顶部图中框选区域的高倍图像。比例尺:500 µm(顶部图),20 µm(底部图)。d 纹状体中 Kremen1+ SPNs 中 Drd1+、Drd2 + 和 Drd1/Drd2+ SPNs 的百分比(n = 3 只小鼠)。e 纹状体中总 SPNs 中 Drd1+、Drd2 + 和 Drd1/Drd2+ SPNs 的百分比(n = 3 只小鼠)。f Kremen1+ SPNs 分布在背侧(dStr)和腹侧(vStr)纹状体的百分比(n = 3 只小鼠)。g Kremen1+ SPNs 分布在斑片和基质区域以及整个背侧纹状体的百分比(n = 3 只小鼠)。h 在三只不同的小鼠中,Kremen1+ SPNs 在斑片区域(652.2 ± 21.01 个细胞 /mm²)的密度显著高于基质区域(83.32 ± 6.94 个细胞 /mm²)。配对 t 检验,双尾,t (2) = 17.44,**p = 0.0033。i 从三只不同小鼠的五个代表性冠状半脑切片中量化了斑片区域(487.9 ± 41.93 个细胞)和基质区域(652.8 ± 32.94 个细胞)中 Kremen1+ SPNs 的平均数量。配对 t 检验,双尾,t (2) = 6.07,*p = 0.026。所有误差线均表示为平均值 ± 标准误。
Tshz1 也在斑片区域富集。我们通过 RNAscope 原位杂交技术进一步比较了 Kremen1 + 和 Tshz1+ SPNs,特别是背侧纹状体中的 dSPNs 的分布情况。我们发现 Kremen1+ SPNs 在斑片区域的分布范围比 Tshz1+ SPNs 更大(补充图 1a,b)。这两个 dSPN 亚群之间只有大约 15-20% 的重叠(补充图 1c,d)。这些结果表明,Kremen1 + 和 Tshz1 + 标记了背侧纹状体中两种在很大程度上不同的斑片 SPNs 亚型。它们合起来约占与斑片相关的 SPNs 的 70%(补充图 1e)。
02. Kremen1 2A-Cre 基因敲入小鼠对研究与斑片相关的 SPNs 很有用
鉴于 Kremen1 在斑片 SPNs 中的富集,我们使用 CRISPR/Cas9 介导的基因编辑技术培育了一种 Kremen12A-Cre 基因敲入(KI)小鼠品系(补充图 2)。通过将这些小鼠与 Ai14 报告基因小鼠杂交,Ai14 报告基因小鼠在 Cre 依赖的调控下表达红色荧光蛋白 tdTomato,我们在 Kremen12A-Cre;Ai14 小鼠的背侧纹状体中观察到了分散的独特 tdTomato 信号,而在腹侧纹状体中则没有(图 2a)。这些信号与广泛使用的斑片标记物 MOR1 共定位(图 2a,b)。与 RNAscope 分析结果一致(图 1i),通过 MOR1 免疫染色确定的斑片区域和基质区域中 tdTomato+ SPNs 的数量相当(补充图 3)。除了 SPNs 外,在周细胞中也检测到了 tdTomato 信号,而在背侧纹状体的中间神经元或神经胶质细胞中未检测到染色(补充图 4a,b)。Kremen1+ SPNs 局限于背侧纹状体,但沿着头端到尾端以及内侧到外侧的轴分布在整个背侧纹状体中(补充图 5a,b)。除了背侧纹状体之外,在海马区域也可见 tdTomato 信号(图 2c,补充图 5b)。值得注意的是,传入的 tdTomato 阳性 dSPN 轴突表现出独特的树突花束样结构,与黑质(SN)中多巴胺能神经元(DANs)的树突形成连接(图 2d)。
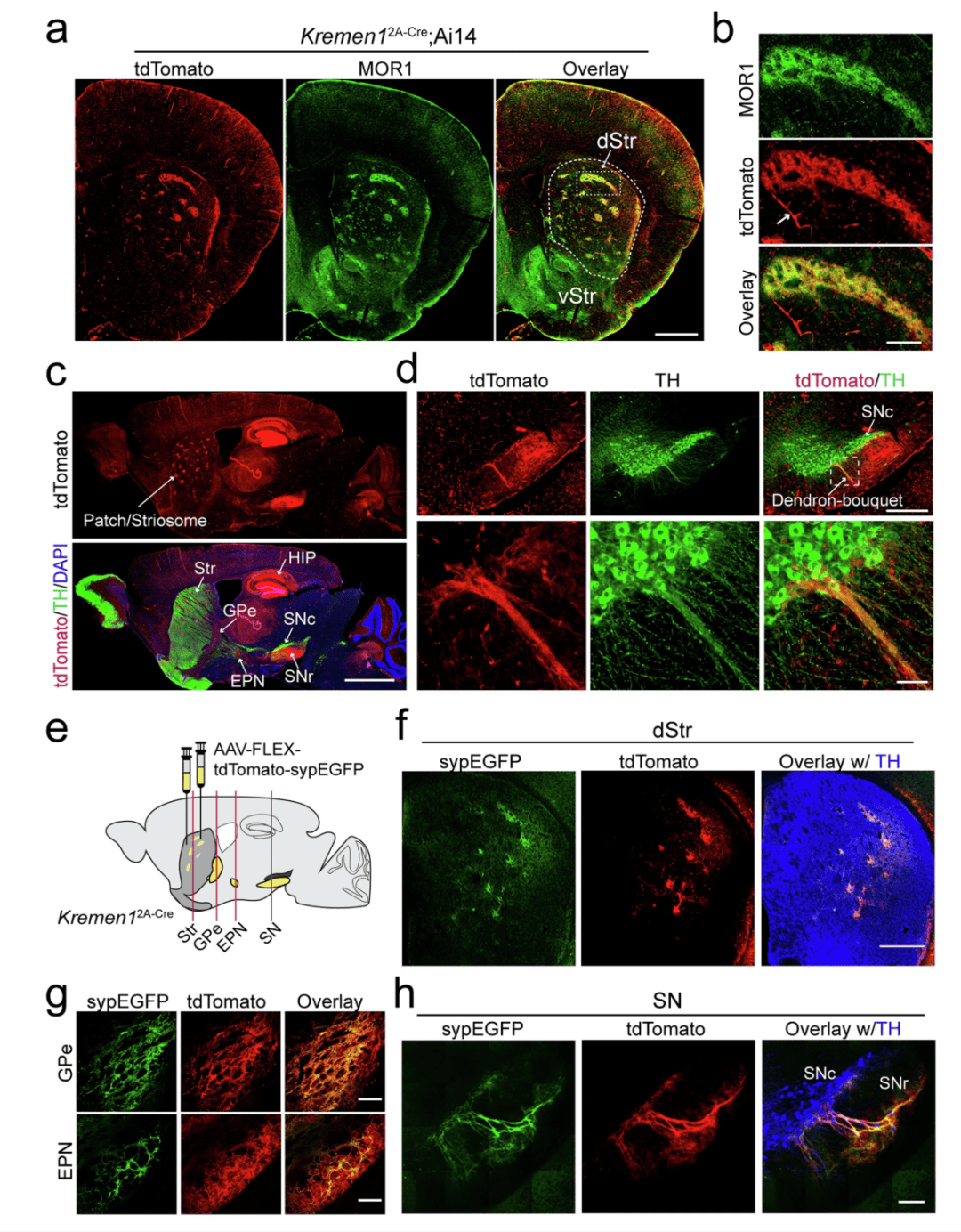
图 2:Kremen1+ SPNs 在背侧纹状体中的独特分布模式及其投射情况。a Kremen12A-Cre;Ai14 小鼠背侧纹状体中 tdTomato(红色)和 MOR1(绿色)的代表性图像。dStr:背侧纹状体。vStr:腹侧纹状体。比例尺:1 毫米。b (a)中框选区域的放大图像。箭头指向也表达 tdTomato 的周细胞。比例尺:200 微米。c 一只代表性 Kremen12A-Cre;Ai14 小鼠的脑部矢状切片的样本图像。tdTomato 信号在纹状体(Str)、苍白球外侧部(GPe)、脚内核(EPN)、黑质(SN)和海马体(HIP)的斑片区域中很明显。比例尺:2 毫米。d 黑质区域的代表性图像,显示 tdTomato 阳性 SPN 轴突终末与黑质网状部(SNr)中多巴胺能神经元的树突相连,形成了所谓的树突花束结构。下图显示了上图中框选区域的放大图像。比例尺:500 微米(上图),50 微米(下图)。e 在 Kremen12A-Cre 小鼠的背侧纹状体中注射 AAV9-FLEX-tdTomato-synEGFP 的示意图。红色垂直线表示(f–h)中冠状切片的位置。f–h 背侧纹状体(dStr)、苍白球外侧部(GPe)、脚内核(EPN)和黑质(SN)中 tdTomato(红色)、突触小泡相关蛋白融合增强型绿色荧光蛋白(sypEGFP,绿色)和酪氨酸羟化酶(TH,蓝色)染色的图像。比例尺:背侧纹状体中为 500 微米,苍白球外侧部和脚内核中为 200 微米,黑质中为 100 微米。
为了研究 Kremen1+ SPNs 的投射模式,我们将共表达 Cre 依赖型 tdTomato 和与突触素融合的增强型绿色荧光蛋白(sypEGFP)的腺相关病毒(AAV)载体立体定位注射到 Kremen12A-Cre 基因敲入(KI)小鼠的背侧纹状体中(图 2e)。在背侧纹状体的类似斑片区域中都发现了 tdTomato 和 sypEGFP 信号(图 2f)。此外,sypEGFP 特异性标记了 Kremen1+ SPNs 在苍白球外侧部(GPe)和脚内核(EPN,小鼠中相当于苍白球内侧部 GPi)(图 2g)以及黑质网状部(SNr)和黑质致密部(SNc)(图 2h)中的轴突终末。当在 Calb1IRES2-Cre 小鼠中进行类似的 AAV 注射时,在以 MOR1 低表达为特征的基质区域中观察到了 tdTomato 和 sypEGFP 信号(补充图 6a,b)。发现 Calb1+ SPNs 的轴突终末投射到苍白球外侧部(GPe)、脚内核(EPN)和黑质(SN)(补充图 6c,d)。在黑质网状部(SNr)中,观察到 Calb1+ dSPNs 的轴突终末与 TH + 多巴胺能神经元(DANs)的树突之间有明显的重叠(补充图 6d,e)。因此,Kremen12A-Cre 和 Calb1IRES2-Cre 基因敲入小鼠分别为研究与斑片或基质相关的 SPNs 的解剖结构和功能作用提供了有用的工具。
03. 在运动开始和结束时 Kremen1 + 和 Calb1+ dSPNs 的不同活动变化
为了研究在自主节奏运动期间 Kremen1 + 和 Calb1+ dSPNs 的活动模式,我们将表达基因编码的钙指示剂 GCaMP8s(AAV1-FLEX-GCaMP8s)的 AAV 载体注射到 Kremen12A-Cre 或 Calb1IRES2-Cre 小鼠的背侧纹状体中,并在同一半球的黑质网状部(SNr)中植入一根光纤(图 3a,b)。小鼠头部固定,在皮带式跑步机上自由行走,运动速度信号与光纤光度测定装置同步,用于记录 Kremen1 + 或 Calb1+ SPNs 轴突终末中的钙瞬变(图 3c–e,补充图 7)。代表性的样本记录显示,Kremen1 + 和 Calb1+ dSPNs 轴突终末中的钙瞬变与运动过程中的速度变化相关(图 3f,g)。然而,当将它们的平均活动与运动开始和结束时间对齐时,出现了明显的差异(图 3h,i)。在运动开始时,与 Calb1+ dSPNs 相比,Kremen1+ dSPNs 达到其活动峰值的时间更晚(图 3j)。值得注意的是,Calb1+ dSPN 活动在运动开始前就开始上升,而 Kremen1+ dSPN 活动上升得晚得多,并且大多在运动开始后才上升(图 3k)。在运动结束时,与 Calb1+ dSPNs 相比,Kremen1+ dSPNs 的活动峰值时间延迟(图 3l)。此外,在运动结束前,这两种亚型的活动斜率有明显差异:Kremen1+ dSPNs 表现出上升趋势(正斜率),而 Calb1+ dSPNs 表现出下降趋势(负斜率)(图 3m)。这些不同的活动模式突显了它们在调节运动活动中的不同作用,Kremen1+ dSPNs 可能有助于运动的终止,而 Calb1+ dSPNs 有助于运动的发起。当比较单个小鼠的运动速度时,Calb1IRES2-Cre 小鼠在运动开始时的平均速度略高于 Kremen12A-Cre 小鼠(补充图 8a–c)。然而,在运动结束时没有观察到速度的显著差异,并且在运动开始或结束时,两组之间的速度变化形状也没有差异(补充图 8a,b,d)。尽管如此,我们认为小鼠品系差异并不能解释在运动开始和结束时 Kremen1 + 和 Calb1+ dSPN 活动的不同动态变化。
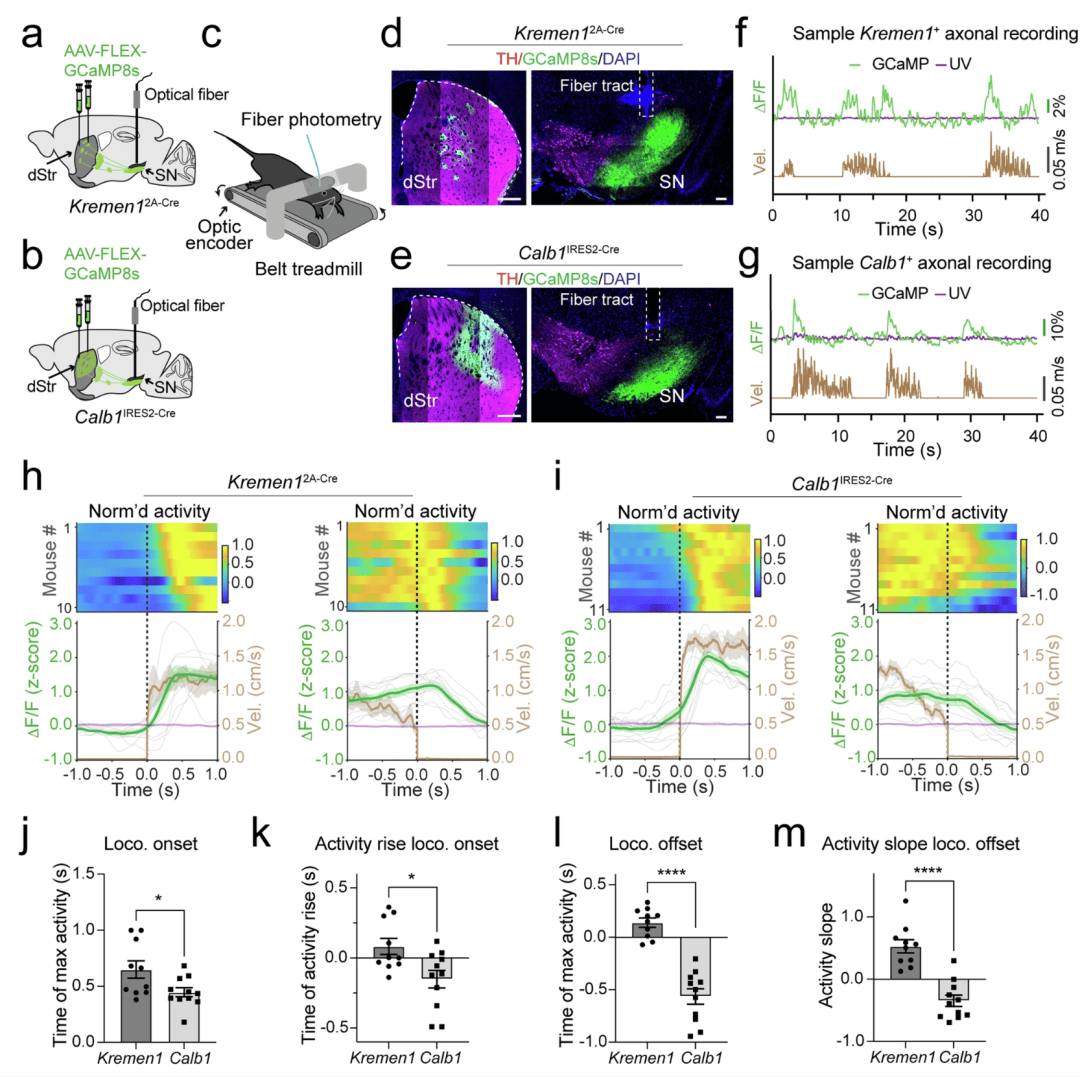
图 3:在自主节奏运动期间 Kremen1 + 和 Calb1+ dSPNs 的活动。a,b 用于记录 Kremen1+(a)和 Calb1+ dSPNs(b)活动的 AAV 注射和光纤植入的示意图。c 图示为一只头部固定且在皮带式跑步机上植入了光纤的小鼠。d,e Kremen12A-Cre(d)和 Calb1IRES2-Cre 小鼠(e)的背侧纹状体(dStr)和黑质(SN)中 GCaMP8s(绿色)、酪氨酸羟化酶(TH,品红色)和 4',6 - 二脒基 - 2 - 苯基吲哚(DAPI,蓝色)的图像。黑质中的光纤轨迹已标明。比例尺:背侧纹状体(dSTR)中为 500 微米,黑质(SN)中为 100 微米。f,g 来自一只代表性 Kremen12A-Cre(f)和一只 Calb1IRES2-Cre 小鼠(g)的 GCaMP8s(绿色)和紫外等吸收点(紫色)的样本记录,以及相应的速度(棕色)记录。h,i 上方的热图显示了单个小鼠中 Kremen1+(h)和 Calb1+(i)dSPNs 的标准化平均活动。下方的图表描绘了 Kremen1+(h,n = 10 只小鼠)和 Calb1+(i,n = 11 只小鼠)dSPN 活动的群体平均值(绿色)和个体动物数据(灰色),以及群体平均紫外等吸收点(紫色)和群体平均速度记录(棕色),与运动开始(左)和结束(右)时间对齐。数据以平均值(实线)± 标准误(阴影区域)表示。j 运动开始时最大活动的时间。Kremen1(n = 10 只小鼠):0.65 ± 0.08 秒;Calb1(n = 11 只小鼠):0.45 ± 0.04 秒。非配对 t 检验,双尾,t (19) = 2.40,*p = 0.027。k 运动开始时活动上升超过基线的时间。Kremen1(n = 10 只小鼠):0.08 ± 0.06 秒;Calb1(n = 11 只小鼠):-0.15 ± 0.06 秒。非配对 t 检验,双尾,t (19) = 2.73,*p = 0.013。l 运动结束时最大活动的时间。Kremen1(n = 10 只小鼠):0.14 ± 0.04 秒;Calb1(n = 11 只小鼠):-0.56 ± 0.07 秒。非配对 t 检验,双尾,t (19) = 8.01,****p = 1.6e-7。m 运动结束前活动的斜率。Kremen1(n = 10 只小鼠):0.53 ± 0.11;Calb1(n = 11 只小鼠):-0.35 ± 0.09。非配对 t 检验,双尾,t (19) = 6.27,****p = 5.1e-6。所有误差线均表示为平均值 ± 标准误。
04. Kremen1 + 和 Calb1+ dSPNs 在运动控制中发挥着相反的作用
为了研究 Kremen1+ dSPN 活动对运动的因果影响,我们采用光遗传学操作方法,将包含 Cre 依赖型光遗传学激活剂通道视紫红质 - 2(AAV1-FLEX-ChR2)的 AAV 载体引入 Kremen12A-Cre 小鼠的背侧纹状体中,并在黑质(SN)中植入光纤,用于对 Kremen1+ dSPN 轴突终末进行光刺激(图 4a,b)。以 3 毫瓦 / 20 赫兹的强度进行 3 分钟的光遗传学激活,导致运动速度显著降低,随后在刺激期结束后运动活动出现反弹(图 4c,d)。步行速度的下降可能是由于每次移动时的速度降低(图 4e)以及运动活动减少所致,这体现在运动频率降低、持续时间缩短(图 4f,g),以及静止频率增加(图 4h)。在各种刺激参数下,包括连续 0.25 毫瓦的功率强度、10 赫兹的刺激频率和 10 秒的持续时间,也观察到了运动速度的下降(补充图 9a–c)。相比之下,对 Calb1IRES2-Cre 小鼠的 Calb1+ dSPNs 进行光遗传学激活产生了相反的结果,导致运动速度大幅增加,同时移动速度和持续时间增加,静止频率和持续时间减少(图 4i–p,补充图 9d–f)。综上所述,这些发现表明 Kremen1 + 和 Calb1+ dSPNs 在运动控制中发挥着相反的作用。
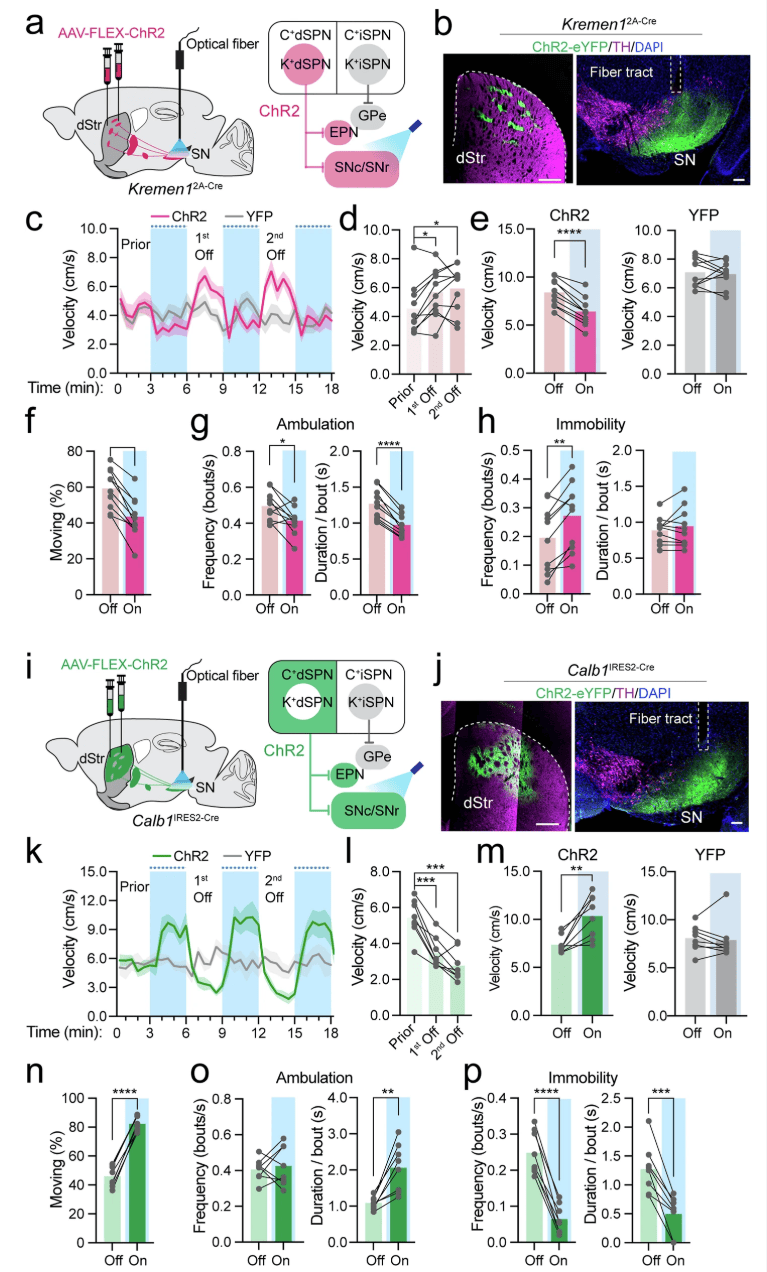
图 4:在运动过程中对 Kremen1 + 和 Calb1+ dSPNs 进行光遗传学激活。a,i 激活 Kremen1+(a)和 Calb1+(i)dSPNs 的实验设计。b,j 显示 Kremen12A-Cre 小鼠(b)和 Calb1IRES2-Cre 小鼠(j)中 ChR2(绿色)、酪氨酸羟化酶(TH,品红色)和 4',6 - 二脒基 - 2 - 苯基吲哚(DAPI,蓝色)的代表性图像。比例尺:背侧纹状体(dStr)中为 500 微米,黑质(SN)中为 100 微米。c,k Kremen12A-Cre(c)和 Calb1IRES2-Cre 小鼠(k)在旷场试验中的瞬时运动速度。蓝色阴影区域表示光照开启状态。YFP 代表黄色荧光蛋白对照组。数据以平均值(实线)± 标准误(阴影区域)表示。d,l 比较 Kremen1-ChR2(d)和 Calb1-ChR2 小鼠(l)在刺激前、第一次光照关闭和第二次光照关闭时的平均速度。对于 Kremen1-ChR2,单因素方差分析,F(1.43,12.85) = 5.587,*p = 0.025,多重比较:刺激前与第一次光照关闭相比,*p = 0.013;刺激前与第二次光照关闭相比,*p = 0.035。对于 Calb1-ChR2:F (1.62, 11.31) = 38.96,****p = 6.3e-5,多重比较:刺激前与第一次光照关闭相比,***p = 0.0004;刺激前与第二次光照关闭相比,***p = 0.0004。e Kremen1-ChR2(t (9) = 10.08,****p = 1.9e-6)和 Kremen1-YFP(t (9) = 0.50,p = 0.63)在移动期间的平均速度。f–h Kremen1-ChR2 小鼠在移动期间的移动时间百分比(f,t (9) = 7.41,****p = 4.1e-5)、频率(t (9) = 2.86,**p = 0.02)和持续时间(t (9) = 9.67,****p = 4.8e-5),静止期间的频率(t (9) = 4.4,**p = 0.002)和持续时间(t (9) = 0.87,p = 0.41)(h)。(c–h)中每组有 10 只小鼠。m Calb1-ChR2(t (7) = 4.18,**p = 0.004)和 Calb1-YFP(t (7) = 0.44,p = 0.67)的平均移动速度。n–p Calb1-ChR2 小鼠在移动期间的移动时间百分比(n,t (7) = 22.74,****p = 8.06e-8)、频率(t (7) = 0.48,p = 0.65)和持续时间(t (7) = 4.8,**p = 0.002),静止期间的频率(t (7) = 11.41,****p = 8.9e-6)和持续时间(t (7) = 6.4,***p = 0.0004)(p)。(k–p)中每组有 8 只小鼠。两个特定组之间的比较采用配对 t 检验,双尾。所有误差线表示平均值 ± 标准误。
05. Kremen1 + 和 Calb1+ dSPNs 对运动的状态依赖型调节
为了研究 Kremen1 + 和 Calb1+ dSPN 激活的效果是否取决于运动状态,我们进一步分析了 10 秒、3 毫瓦 / 20 赫兹的刺激数据集(补充图 9c,f),将试验分为刺激开始前或结束后立即处于静止或移动状态的情况(图 5a–d)。激活 Kremen1+ dSPNs 会立即抑制正在进行的移动,但当小鼠处于静止状态时,会轻微增加运动(图 5a,c)。相反,激活 Calb1+ dSPNs 对正在进行的移动没有立即产生影响,但当小鼠在刺激前处于静止状态时,会引发移动(图 5b,d)。此外,Kremen1+ dSPN 激活的终止导致运动速度增加,而 Calb1+ dSPN 刺激的终止导致运动速度降低(图 5e,f)。因此,这些发现突显了 Kremen1 + 和 Calb1+ dSPNs 在运动调节中的相反作用,这种作用受到激活时运动状态的影响。
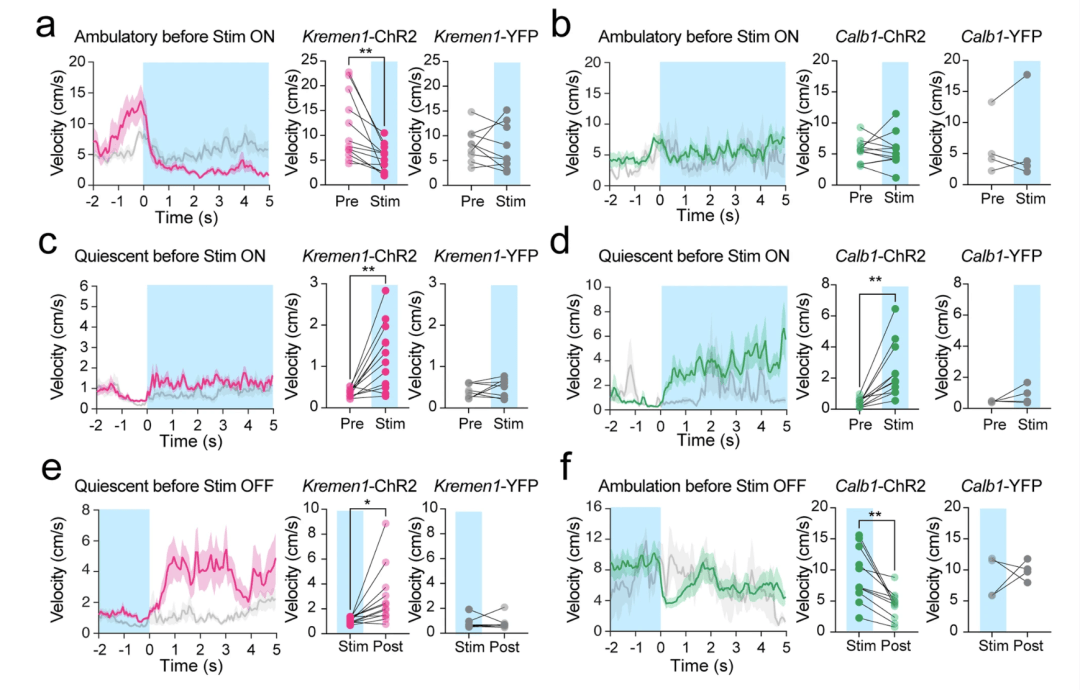
图 5:对 Kremen1 + 和 Calb1+ dSPNs 进行光遗传学激活对运动产生了状态依赖型调节。a,b 当小鼠在刺激开始前处于移动状态时,对 Kremen1+ dSPN(a,左)和 Calb1+ dSPNs(b,左)进行刺激的平均速度曲线,蓝色区域表示前 5 秒的刺激,红色 / 绿色曲线表示 ChR2 小鼠,灰色曲线表示 YFP 小鼠。使用刺激前 1 秒和刺激中 1 秒的平均速度进行配对 t 检验,双尾。Kremen1-ChR2 小鼠(a,中):t (11) = 3.70;**p = 0.0035,n = 12 只小鼠。Kremen1-YFP(a,右):p = 0.72,n = 9 只小鼠。Calb1-ChR2 小鼠(b,中):t (10) = 0.05,p = 0.96,n = 11 只小鼠。Calb1-YFP(b,右):p = 0.77,n = 4 只小鼠。c,d 当小鼠在刺激开始前处于静止 / 低运动状态时,对 Kremen1+ dSPN(c,左)和 Calb1+ dSPNs(d,左)进行刺激的平均速度曲线。使用刺激前 1 秒和刺激中 1 秒的平均速度进行配对 t 检验,双尾。Kremen1-ChR2 小鼠(c,中):t (11) = 4.10,**p = 0.0018,n = 12 只小鼠。Kremen1-YFP(c,右):p = 0.32,n = 9 只小鼠。Calb1-ChR2 小鼠(d,中):t (10) = 4.10,**p = 0.0022,n = 11 只小鼠。Calb1-YFP(d,右):p = 0.27,n = 4 只小鼠。e 当小鼠在刺激结束前处于静止 / 低运动状态时,对 Kremen1+ dSPN 进行刺激的平均速度曲线。阴影区域表示刺激的最后 2 秒。使用刺激结束前 1 秒和刺激结束后 1 秒的平均速度进行配对 t 检验,双尾。Kremen1-ChR2 小鼠:t (11) = 2.86,*p = 0.016,n = 12 只小鼠。Kremen1-YFP:p = 0.91,n = 9 只小鼠。f 当小鼠在刺激结束前处于移动状态时,对 Calb1+ dSPN 进行刺激的平均速度曲线。使用刺激结束前 1 秒和刺激结束后 1 秒的平均速度进行配对 t 检验,双尾。Calb1-ChR2 小鼠:t (11) = 4.26 **p = 0.0017,n = 11 只小鼠。Calb1-YFP:p = 0.66,n = 4 只小鼠。所有误差线表示平均值 ± 标准误。速度曲线中的数据以平均值(实线)± 标准误(阴影区域)表示。
06. Kremen1 + 间接通路棘状投射神经元(iSPNs)在运动控制中作用有限
为了研究 Kremen1+ iSPNs 在运动方面的作用,我们将包含依赖 Cre 和 Flp 的光遗传学激活剂的腺相关病毒(AAV)载体(AAV1-ConFon-ChR2)引入 Kremen12A-Cre;A2a2A-Flp 双基因敲入(KI)小鼠的背侧纹状体中(图 6a)。Kremen1+ iSPNs 专门投射到苍白球外侧部(GPe),而不投射到脚内核(EPN)或黑质网状部(SNr)(图 6b,c;补充图 10a)。对位于苍白球外侧部(GPe)的 Kremen1+ iSPNs 的轴突终末进行光刺激(图 6b,c;补充图 10b)。以 3 毫瓦 / 20 赫兹的高功率刺激 3 分钟,导致平均速度和每次运动的持续时间适度增加(图 6d–h),而在 0.25 毫瓦的低光功率持续刺激下,我们没有观察到运动速度有任何明显变化(图 6i)。这些结果强调了 Kremen1+ iSPNs 在调节运动方面的作用有限。实际上,对 Kremen12A-Cre 小鼠中的 Kremen1 + 直接通路棘状投射神经元(dSPNs)和 iSPNs 进行化学遗传学激活,导致运动活动减少(补充图 11),这支持了 Kremen1+ dSPNs 在抑制运动方面的主要作用。
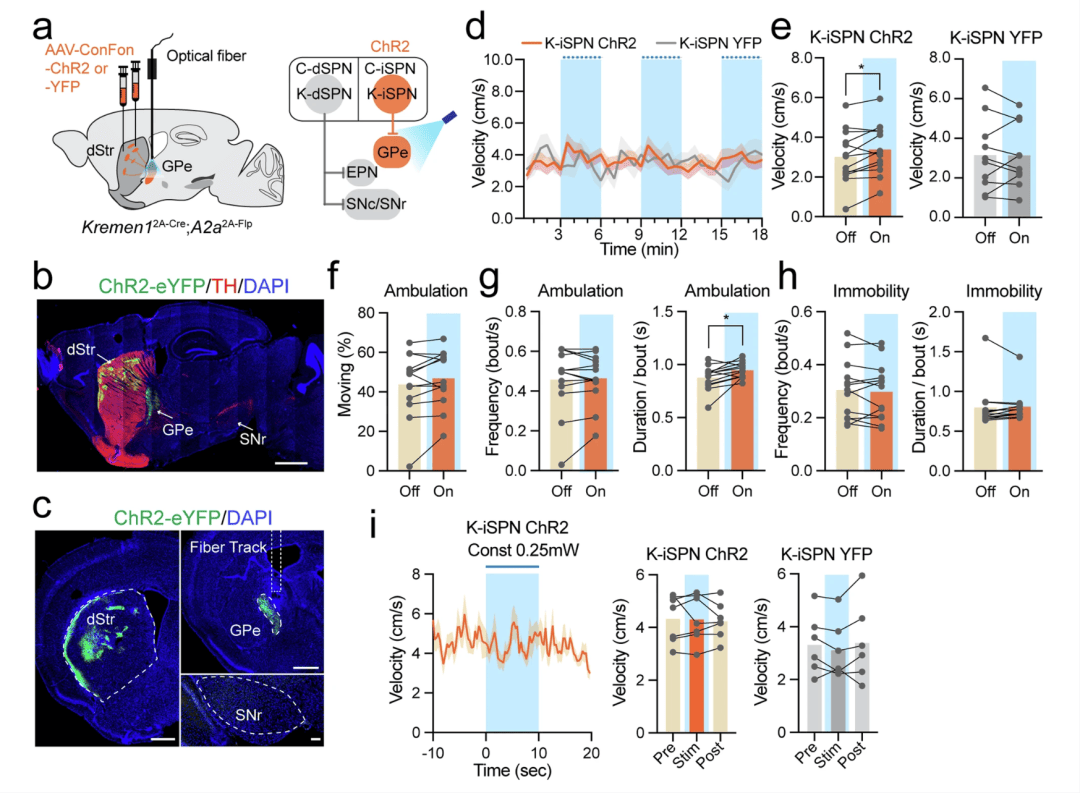
图 6:对 Kremen1+ iSPNs 进行光遗传学激活导致运动适度增加。a 示意图展示了在 Kremen12A-Cre;A2aFlp 小鼠中,为了激活苍白球外侧部(GPe)中 Kremen1+ iSPNs 轴突而进行的 ChR2 注射和光纤植入。b,c 矢状切片(b)和冠状切片(c)的代表性图像,展示了 Kremen1+ iSPNs 中 ChR2(绿色)的表达。比例尺:1 毫米(矢状切片),500 微米(背侧纹状体(dStr)和苍白球外侧部(GPe)),100 微米(黑质(SN))。d 在旷场试验中,比较光照关闭和光照开启(蓝色阴影区域)条件下的瞬时运动速度。ChR2 组 = 13 只小鼠,YFP 组 = 10 只小鼠。平均值(实线)± 标准误(阴影区域)。e 光照关闭(Off)和光照开启(On)期间的平均速度。ChR2 组:t (12) = 2.85,配对 t 检验,双尾,*p = 0.015,n = 13 只小鼠。YFP 组:t (9) = 0.06,配对 t 检验,双尾,p = 0.95,n = 10 只小鼠。数据展示了每只小鼠的情况以及群体平均值。f ChR2 组在光照关闭和光照开启期间的总移动时间百分比:t (12) = 1.84,配对 t 检验,双尾,p = 0.09。g ChR2 组中移动次数的频率(左,t (12) = 0.42,配对 t 检验,双尾,p = 0.68)和持续时间(右,t (12) = 2.82,配对 t 检验,双尾,*p = 0.016),n = 13 只小鼠。h ChR2 组中静止次数的频率(左,t (12) = 0.65,配对 t 检验,双尾,p = 0.53)和持续时间(右,t (12) = 0.53,配对 t 检验,双尾,p = 0.61),n = 13 只小鼠。i 与对 Kremen1+ iSPNs 进行 0.25 毫瓦 / 持续光刺激(10 秒)时间对齐的瞬时速度(左)。平均值(实线)± 标准误(阴影区域)。ChR2 组(中)和 YFP 组(右)在刺激前(Pre)、刺激期间(Stim)和刺激后(Post)的平均速度。对于 ChR2 组:单因素方差分析,F (1.868, 11.21) = 0.14,p = 0.85,n = 7 只小鼠;对于 YFP 组:单因素方差分析,F (1.577, 7.886) = 1.22,p = 0.33,n = 6 只小鼠。所有误差线均表示为平均值 ± 标准误。
07. Kremen1 + 和 Calb1+ dSPNs 对多巴胺释放的调节方式不同
为了研究 Kremen1 + 和 Calb1+ dSPNs 在神经回路层面如何不同地调节运动,我们研究了 dSPN 活动对背侧纹状体中多巴胺释放的影响。Kremen1 + 和 Calb1+ dSPNs 都支配黑质纹状体多巴胺能神经元(DANs)并调节它们的活动。先前的研究表明,对斑片神经元进行光遗传学刺激可以抑制多巴胺释放。我们使用基因编码的多巴胺传感器 GRABrDA3m 和依赖 Cre 的 ChR2,通过对每个小鼠品系的黑质网状部(SNr)进行光遗传学刺激后,利用光纤光度测定法评估了 Kremen12A-Cre(图 7a,b)和 Calb1IRES2-Cre(图 7a,c)小鼠背侧纹状体中的多巴胺释放情况。激活 Kremen1+ dSPNs 导致多巴胺水平以刺激剂量依赖的方式逐渐降低,刺激频率为 20 赫兹,持续时间分别为 2 秒、5 秒和 15 秒(图 7d)。相比之下,激活 Calb1+ dSPNs 导致多巴胺释放出现双相变化:在光刺激开始时,多巴胺信号最初短暂增加,随后在刺激期间减少(图 7d)。在不同的刺激频率和持续时间下,Calb1+ dSPN 激活后多巴胺释放的最初激增都存在(图 7e)。然而,与 Kremen1+ dSPNs 刺激相比,Calb1+ dSPNs 刺激导致的多巴胺释放减少幅度要小得多(图 7f)。此外,只有 Kremen1+ dSPN 刺激导致刺激后多巴胺释放反弹(图 7g),这与之前在脑片实验中观察到的斑片 dSPN 刺激后 DANs 反弹放电的现象一致。当以 10 赫兹的频率刺激神经元时,也观察到了 Kremen1 + 和 Calb1+ dSPNs 对多巴胺释放的不同调节模式(补充图 12)。这些发现表明,Kremen1 + 和 Calb1+ dSPNs 对多巴胺释放的调节方式不同,Kremen1+ dSPN 激活会导致对多巴胺释放更有效的抑制。
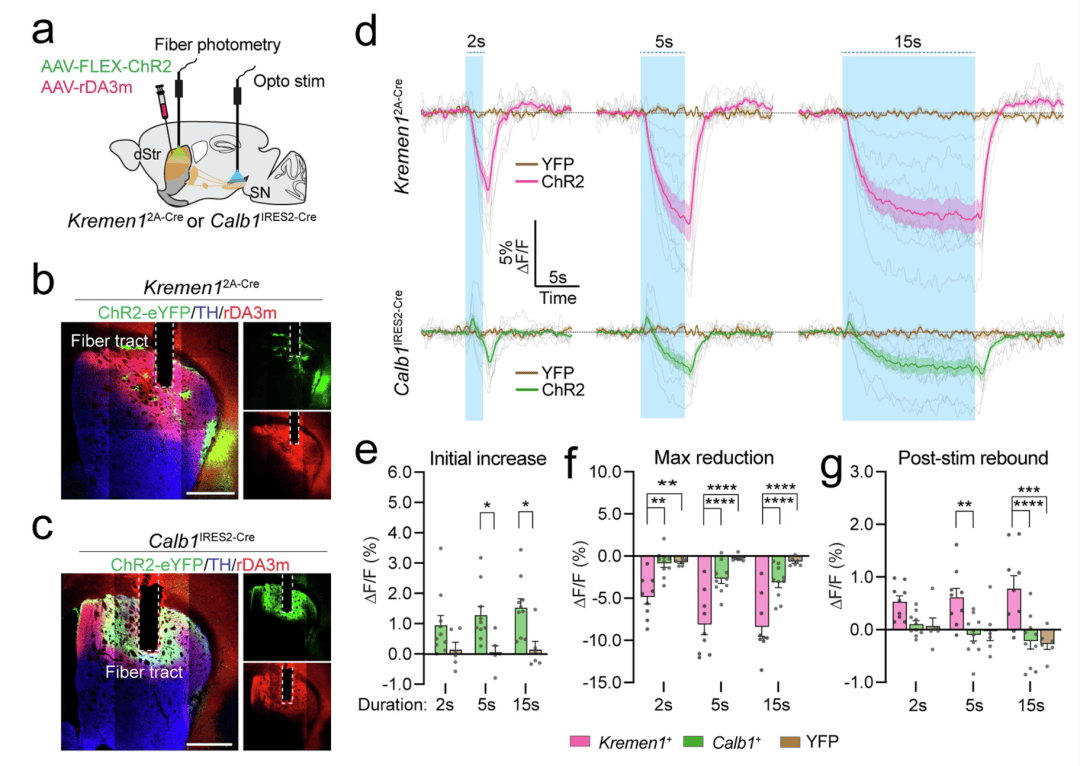
图 7:Kremen1 + 和 Calb1+ dSPNs 对多巴胺释放的调节不同。a 同时进行光纤光度测定法和光遗传学实验以评估背侧纹状体中多巴胺变化的示意图,该变化是对 Kremen1 + 和 Calb1+ dSPN 激活的反应。b,c 显示 Kremen12A-Cre(b)和 Calb1IRES2-Cre(c)小鼠背侧纹状体中 ChR2(绿色)、rDA3m(红色)和酪氨酸羟化酶(TH,蓝色)的代表性图像。比例尺:500 微米。d 在 Kremen12A-Cre(上)和 Calb1IRES2-Cre(下)小鼠中,对黑质(SN)进行不同持续时间的 20 赫兹光刺激期间的多巴胺信号变化。带阴影的实线表示与刺激开始时间对齐的 ΔF/F 变化的群体平均值 ± 标准误。浅灰色线条表示单个 Kremen1- ChR2(n = 9 只小鼠)和 Calb1- ChR2(n = 10 只小鼠)小鼠的平均 ΔF/F 变化,以及 YFP 组(Kremen1-YFP,n = 3 只小鼠;Calb1-YFP,n = 3 只小鼠)的情况。在(e–g)中使用相同的小鼠数据集进行进一步分析。e 与 YFP 对照组相比,Calb1+ dSPNs 激活后多巴胺的初始升高幅度。双因素方差分析:激活效应 F (1,42) = 19.44,p = 7.1e-5;持续时间效应 F (2,42) = 0.4331,p = 0.6513;交互效应 F (2,42) = 0.4730,p = 0.6264。多重比较:5 秒,p = 0.0258;15 秒,p = 0.0102。f,g 与 YFP 对照组相比,Kremen1 + 和 Calb1+ dSPNs 激活后多巴胺的最大降低幅度(f)和刺激后(post-stim)多巴胺释放变化(g)。f 双因素方差分析:激活效应 F (2,66) = 54.47,p = 1.1e-14;持续时间效应 F (2,66) = 4.723,p = 0.0121;交互效应 F (4,66) = 1.575,p = 0.1914。多重比较,Kremen1-ChR2 与 Calb1-ChR2 相比:2 秒, p = 0.0025;5 秒, p = 1.95e-6;15 秒, p = 3.3e-6;Kremen1-ChR2 与 YFP 相比:2 秒,* p = 0.0087;5 秒,**** p = 9.2e-9;15 秒,**** p = 1.12e-8。g 双因素方差分析:激活效应 F (2,66) = 21.66,*p = 5.9e-8;持续时间效应 F (2,66) = 0.5153,p = 0.5997;交互效应 F (4,66) = 1.234,p = 0.3052。多重比较,Kremen1-ChR2 与 Calb1-ChR2 相比:5 秒, p = 0.0095;15 秒,*** p = 9.06e-6;Kremen1-ChR2 与 YFP 相比:15 秒,*** p = 0.0003。所有数据均表示为平均值 ± 标准误。
08. 在 Aldh1a1 + 多巴胺能神经元(DANs)中对 GABA-B 受体 Gabbr1 进行基因敲低可促进运动
考虑到 Aldh1a1 + 黑质纹状体 DANs 是黑质致密部(SNc)中纹状体输入的主要接受者,并且会接收由斑片直接通路棘状投射神经元(dSPNs)通过 GABA-B 受体介导的长时间抑制信号,同时 GABBR1 是 DANs 中的主要 GABA 受体(数据来自 PRJNA775656 ,补充图 13a),我们对 Aldh1a1 + 黑质纹状体 DANs 中的 Gabbr1 基因进行了删除。这是通过将依赖 Cre 的靶向 CRISPR/saCas9-Gabbr1sgRNA 的腺相关病毒(AAV)载体输送到 Aldh1a1CreERT2 小鼠的黑质致密部(SNc)中来实现的(图 8a)。这种基因靶向载体特异性地破坏了 Aldh1a1+ DANs 中 GABBR1 的表达,而不影响 Aldh1a1 阴性神经元(图 8b–e,补充图 14)。在 Aldh1a1 + 黑质纹状体 DANs 中对 Gabbr1 进行基因敲低(KD)后,导致移动速度显著增加(图 8f,g)。这些发现支持了 GABA-B 受体介导的抑制性信号在 Aldh1a1+ DANs 中对调节运动控制的重要作用。
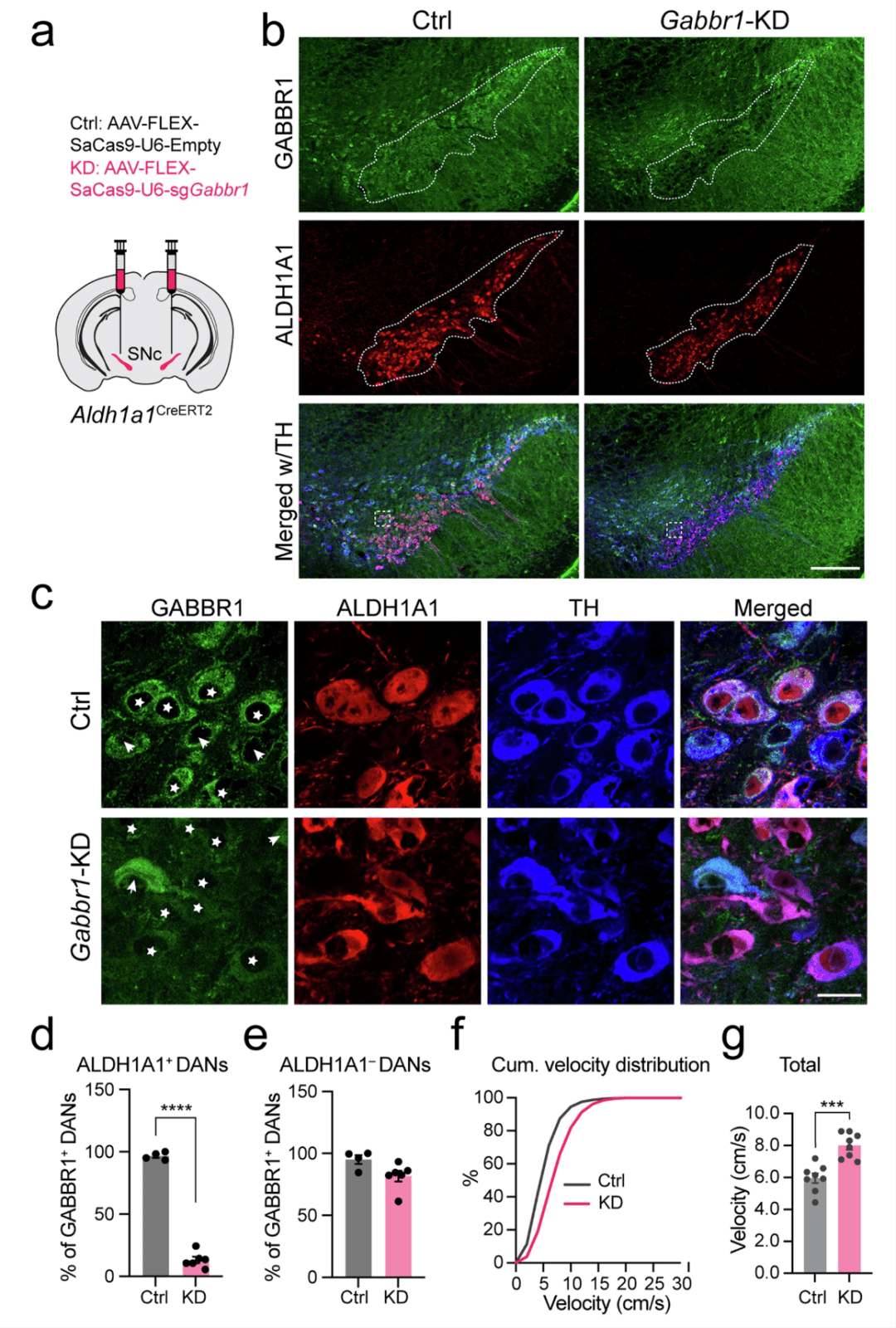
图 8:在 Aldh1a1+ DANs 中敲低 Gabbr1 受体导致活动过度。a 示意图展示了在 Aldh1a1CreERT2 小鼠的黑质致密部(SNc)中注射 Gabbr1 基因敲低(KD)或对照(Ctrl)腺相关病毒(AAV)的情况。b 显示 Gabbr1 对照小鼠和基因敲低小鼠的黑质致密部(SNc)中 GABBR1(绿色)、ALDH1A1(红色)和酪氨酸羟化酶(TH,蓝色)染色的代表性图像。虚线勾勒出富含 Aldh1a1+ DANs 的区域。比例尺:200 微米。c (b)中框选区域的高倍视图。星号表示 Aldh1a1+ DANs,箭头突出显示 Aldh1a1– DANs。比例尺:20 微米。d 黑质致密部(SNc)中 Aldh1a1+ DANs 里 GABBR1 + 神经元的百分比。Gabbr1 对照:96.71 ± 1.49%;Gabbr1 基因敲低:13.22 ± 2.58 %。非配对 t 检验,双尾,****p = 8.6e-9;n = 6 只小鼠(基因敲低组),n = 4 只小鼠(对照组)。e 黑质致密部(SNc)中 Aldh1a1– DANs 里 GABBR1 + 神经元的百分比。Gabbr1 对照:95.10 ± 3.60 %;Gabbr1 基因敲低:81.76 ± 4.38 %。非配对 t 检验,双尾,p = 0.063;n = 6 只小鼠(基因敲低组),n = 4 只小鼠(对照组)。f Gabbr1 对照小鼠和基因敲低小鼠的速度累积频率分布,每组 n = 8 只小鼠。g 在 30 分钟测试期间的平均速度。非配对 t 检验,双尾,***p = 0.0002,每组 n = 8 只小鼠。所有数据均以平均值 ± 标准误表示。
09. Kremen1+ dSPNs 通过 Aldh1a1+ DANs 中的 GABA-B 受体抑制运动
为了研究突触后 GABA-B 受体在 Kremen1+ dSPNs 诱导的运动抑制中的作用,我们通过光遗传学方法选择性激活 Kremen1+ dSPNs,同时下调 Kremen12A-Cre;Aldh1a1CreERT2 双基因敲入(KI)小鼠的 Aldh1a1 + 黑质纹状体 DANs 中的 Gabbr1 表达(图 9a,b)。值得注意的是,黑质(SN)中仅有的 Kremen1 + 细胞是周细胞,它们不表达 GABBR1(补充图 13b)。由于 Gabbr1 基因敲低小鼠和对照小鼠的基础运动情况有所不同(图 8f,g),我们计算了相对于每只小鼠基础值的速度比值,以便进行组间比较。显著的是,在 Aldh1a1 + 黑质纹状体 DANs 中敲低 Gabbr1 完全消除了光刺激期间的运动抑制效应,以及通常由 Kremen1+ dSPN 激活所诱导的刺激后反弹现象(图 9c–e)。相比之下,对照小鼠在刺激期间速度明显降低,并且在刺激后出现反弹效应(图 9c–e)。
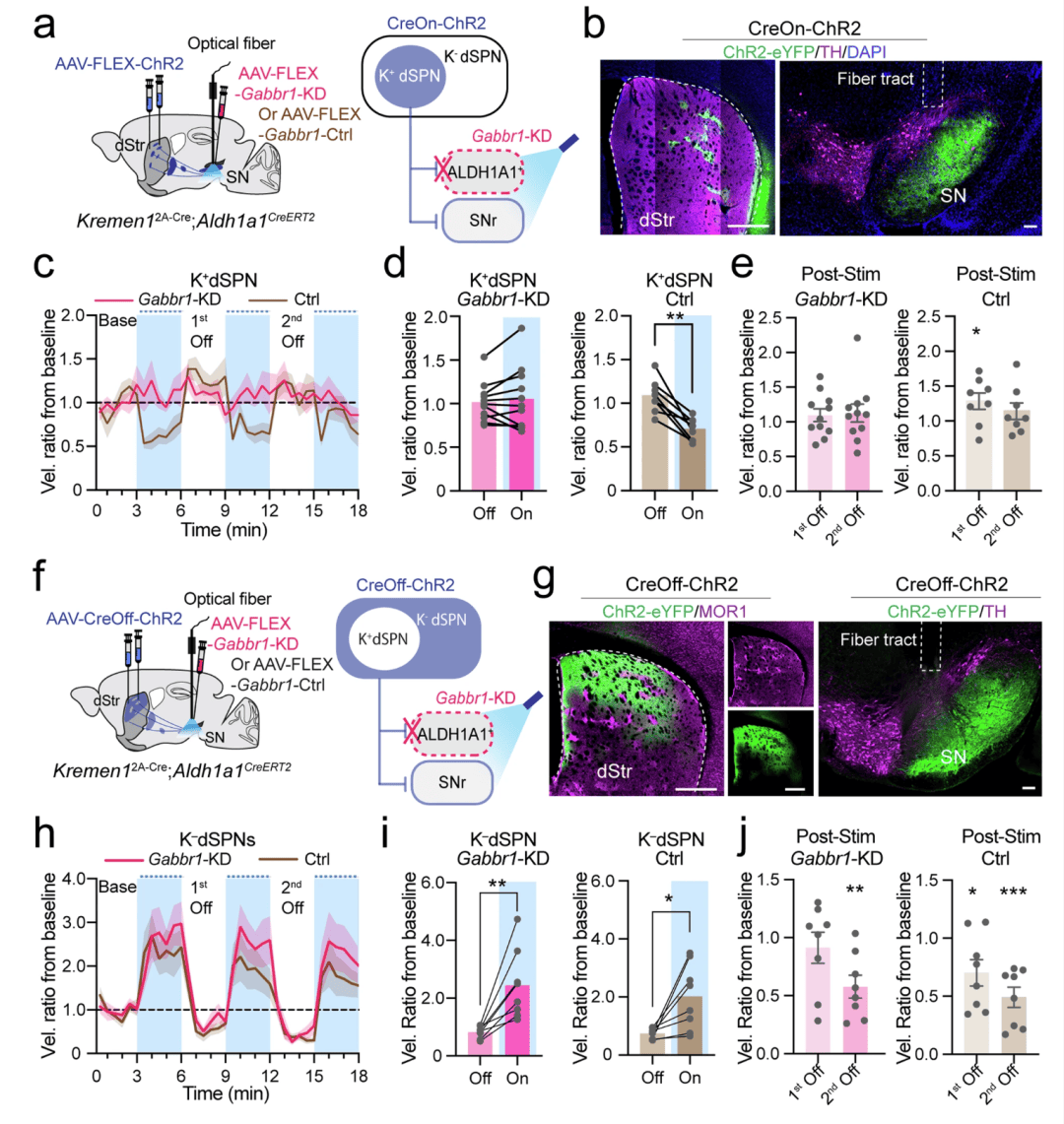
图 9:在 Aldh1a1+ DANs 中敲低 Gabbr1 受体消除了 Kremen1+ dSPN 诱导的运动改变。a 示意图展示了在 Kremen12A-Cre;Aldh1a1CreERT2 双基因敲入小鼠中,选择性激活 Kremen1+ dSPNs(K+dSPN,a)或 Kremen1 阴性 dSPNs(K-dSPN,f),以及在 Aldh1a1+ DANs 中对 Gabbr1 受体进行基因删除(Gabbr1-KD)的情况。b 背侧纹状体和黑质(SN)中 ChR2(绿色)、酪氨酸羟化酶(TH,品红色)和 4',6 - 二脒基 - 2 - 苯基吲哚(DAPI,蓝色)的代表性图像。比例尺:背侧纹状体(dStr)中为 500 微米,黑质(SN)中为 100 微米。c 在 Gabbr1 基因敲低(KD)和对照(Ctrl)条件下,激活 K+dSPN 时在旷场试验中的瞬时运动速度变化(相对于前 3 分钟的基线)。Gabbr1 基因敲低组:n = 11 只小鼠;对照组:n = 8 只小鼠,(c–e)中使用相同的小鼠数据集。d 比较光照关闭和开启期间的速度变化。Gabbr1 基因敲低组:t (10) = 0.72,配对 t 检验,双尾,p = 0.49。对照组(n = 8 只小鼠):t (7) = 5.40,**p = 0.001。e 在 Gabbr1 基因敲低组和对照组中,第一次光照关闭和第二次光照关闭期间的速度变化。单样本 t 检验,双尾。Gabbr1 基因敲低组:第一次光照关闭,p = 0.32;第二次光照关闭,p = 0.35。对照组:第一次光照关闭,*p = 0.045,第二次光照关闭 p = 0.27。g 背侧纹状体中 ChR2(绿色)、MOR1(品红色),以及黑质(SN)中 ChR2(绿色)、酪氨酸羟化酶(TH,品红色)的代表性图像。比例尺:背侧纹状体(dStr)中为 500 微米,黑质(SN)中为 100 微米。h 在 Gabbr1 基因敲低和对照条件下,激活 K–dSPN 时在旷场试验中的瞬时运动速度变化(相对于前 3 分钟的基线)。Gabbr1 基因敲低组:n = 8 只小鼠,对照组:n = 8 只小鼠,(h–j)中使用相同的小鼠数据集。i 比较光照关闭和开启期间的速度变化。Gabbr1 基因敲低组:t (7) = 4.11,配对 t 检验,双尾,**p = 0.0045。对照组:t (7) = 3.26,*p = 0.014。j 在 Gabbr1 基因敲低小鼠和对照小鼠中,第一次光照关闭和第二次光照关闭期间的速度变化。单样本 t 检验,双尾。Gabbr1 基因敲低组:第一次光照关闭,p = 0.54;第二次光照关闭,**p = 0.0035。对照组:第一次光照关闭,*p = 0.035;第二次光照关闭,***p = 0.0006。所有误差线均以平均值 ± 标准误表示。速度曲线中的数据以平均值(实线)± 标准误(阴影区域)表示。
为了探究 GABA-B 受体是否参与 Kremen1 阴性 dSPNs 对运动的调节,我们在对照和 Gabbr1 基因敲低(KD)两种条件下,对 Kremen12A-Cre;Aldh1a1CreERT2 双基因敲入(KI)小鼠中的 Kremen1 阴性 dSPNs 进行了光遗传学刺激(图 9f,g;补充图 15)。尽管刺激 dSPNs 使两组小鼠的运动都显著增加,但在 Aldh1a1 + 黑质纹状体 DANs 中缺乏 GABBR1 并没有改变 Kremen1 阴性 dSPNs 所诱导的运动效应(图 9h–j)。总之,这些发现表明,Kremen1+ dSPNs 通过 GABBR1 信号传导调节 Aldh1a1 + 黑质纹状体 DANs 的活动,从而抑制运动活动。
10. Kremen1+ dSPNs 通过 GABBR1 受体调节 Aldh1a1+ DANs 的活动
为了进一步证实 Kremen1+ dSPNs 通过 GABBR1 受体调节 Aldh1a1+ DANs 的活动来介导对运动的调节,我们使用光纤光度测定法,在对照和 Gabbr1 基因敲低(KD)两种条件下,选择性地测量了在光激活 Kremen1+ dSPNs 期间,Aldh1a1+ DANs 轴突终末中的钙瞬变(图 10a,b)。当以 20 赫兹的频率刺激 15 秒时,与对照组相比,在 Gabbr1 基因敲低小鼠中,光激活 Kremen1+ dSPNs 导致 Aldh1a1+ DANs 轴突终末中的钙瞬变减少的幅度明显更小(图 10c,d;个体记录,补充图 16)。此外,在相同的刺激条件下,Gabbr1 基因敲低消除了在 Kremne1+ dSPN 激活后 Aldh1a1+ DANs 的反弹活动(图 10c,e)。这些发现强调了 Aldh1a1+ DANs 在 Kremen1+ dSPN 调节的运动控制中的关键作用,并确定 GABBR1 受体是一个重要的介导因子(图 10f)。
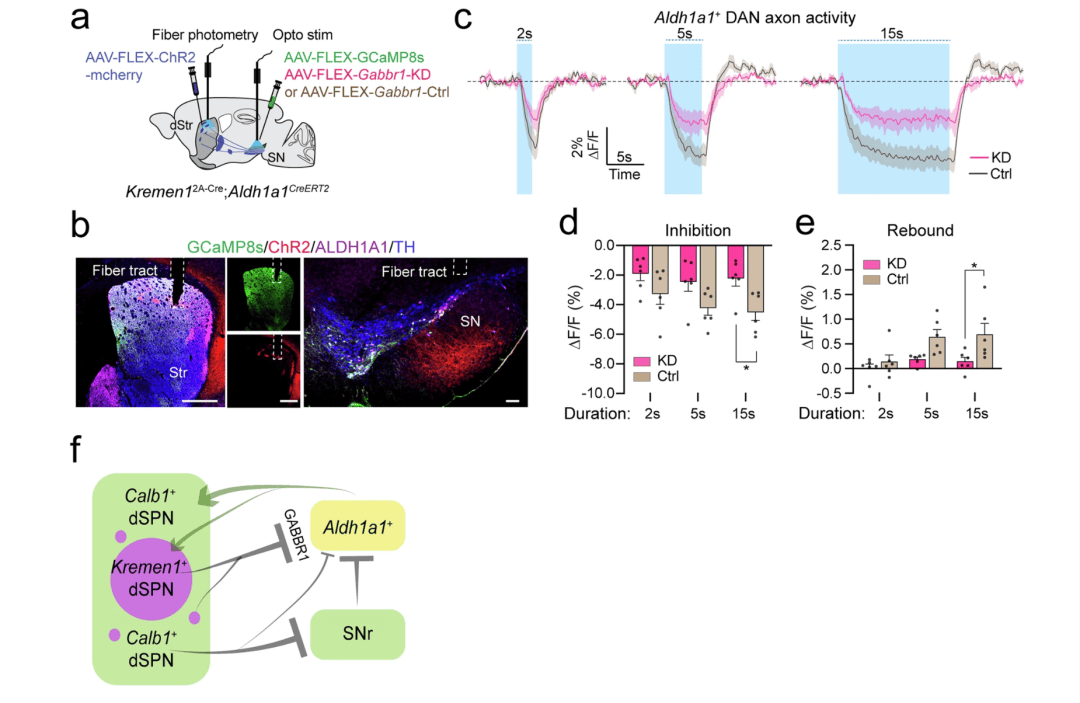
图 10:Gabbr1 受体的基因敲低影响 Kremen1+ dSPN 诱导的 Aldh1a1+ DANs 活动的改变。a 示意图展示了在 Aldh1a1+ DAN 特异性的 Gabbr1 对照(Ctrl)和基因敲低(KD)小鼠中,同时记录 Aldh1a1+ DANs 的活动(通过光纤光度测定法)以及光激活 Kremen1+ dSPNs 的情况。b 显示 Kremen12A-Cre;Aldh1a1CreERT2 双基因敲入小鼠的纹状体(Str)中 ChR2(红色)、GCaMP8s(绿色)、ALDH1A1(品红色)和酪氨酸羟化酶(TH,蓝色)染色的代表性图像。纹状体和黑质(SN)中的光纤位置已标明。比例尺:纹状体(Str)中为 500 微米,黑质(SN)中为 100 微米。c 在 Gabbr1 基因敲低(红色)和对照(棕色)条件下,当在黑质(SN)中光激活 Kremen1+ dSPNs 时,以不同持续时间进行 20 赫兹光刺激期间,背侧纹状体(dStr)中 Aldh1a1+ DAN 轴突终末中 GCaMP8s 信号的变化。数据以每组小鼠的平均值(实线)± 标准误(阴影区域)表示。每组 n = 6 只小鼠。d 在基因敲低和对照条件下,激活 Kremen1+ dSPNs 后 Aldh1a1+ DANs 活动减少的幅度。每组 n = 6 只小鼠。双因素方差分析:刺激持续时间效应,F (2, 30) = 1.202,p = 0.3147;基因型效应,F (1, 30) = 15,***p = 0.0005;交互效应,F (2, 30) = 0.3312,p = 0.72。多重比较检验:*p = 0.024。e 在基因敲低和对照条件下,激活 Kremen1+ dSPNs 后 Aldh1a1+ DANs 活动的刺激后反弹情况。每组 n = 6 只小鼠。双因素方差分析:刺激持续时间效应,F (2, 30) = 4.4651,*p = 0.02;基因型效应:F (1, 30) = 12.20,**p = 0.0015;交互效应,F (2, 30) = 1.408,p = 0.26。多重比较检验:*p = 0.0185。所有误差线均表示为平均值 ± 标准误。f 示意图总结表明,Calb1+ SPNs 促进运动,而 Kremen1+ SPNs 通过 GABBR1 受体抑制 Aldh1a1+ DANs 的活动来终止正在进行的运动。
三、讨论
在这项研究中,我们利用 Kremen1 和 Calb1 在背侧纹状体中的不同表达模式,来研究不同 dSPN 亚型在运动控制中的功能作用。我们发现,虽然激活 Calb1+ dSPNs 会促进运动,这与 dSPNs 的传统作用一致,但 Kremen1+ dSPNs(其中一部分在背侧纹状体中形成类似斑片的簇)会抑制运动。Kremen1 + 和 Calb1+ dSPNs 对运动的这种调节是依赖于运动状态的,会随着它们激活时的运动情境而变化。尽管传统上认为 dSPNs 通过抑制黑质网状部(SNr)的抑制性输出来促进运动,但我们的研究结果表明,Kremen1+ dSPNs 通过 GABBR1 介导的信号传导抑制 Aldh1a1+ DANs,从而抑制运动。这些结果强调了不同 dSPN 亚群对运动的复杂调节,并突显了分子标记物结合靶向神经元操作和记录,在阐明不同神经元亚型和神经回路的特殊功能方面的价值。
虽然先前的研究表明,类似斑片的 dSPNs 会限制运动,但这些发现并不一定适用于整个斑片 dSPN 群体。需要注意的是,基于标记物表达来定义 “斑片” 结构在某种程度上是主观的。在这里,我们将假定的斑片结构定义为五个或更多相邻的 Kremen1+ SPNs 组成的群体,并手动描绘这些簇,其中包括 Kremen1 + 和 Kremen1 阴性神经元。这些圈定的神经元中大约 70% 是 Kremen1 + 或 Tshz1+。值得注意的是,相当数量的基质区域内的神经元也表达斑片标记物。尽管 Kremen1+ SPNs 在基质区域中的密度明显低于在斑片区域中的密度,但这两个区域中 Kremen1+ SPNs 的总数相当。鉴于这种分布情况,在当前的实验条件下,我们无法区分 Kremen1+ dSPN 轴突终末是来自斑片区域还是基质区域。因此,我们避免使用 “斑片” 或 “基质” 这些术语来描述 Kremen1 + 和 Calb1+ SPNs,而是将它们称为分子层面定义的 SPN 亚群。
投射到苍白球内侧部(GPi)的 Tshz1+ dSPNs 在运动中的作用也已被研究过,在位置偏好任务中,Tshz1 + 斑片 dSPNs 与运动抑制有关。然而,在情感效价情境(例如位置偏好测试)下的运动速度变化可能反映的是主动回避或趋近选择的改变,而不是纯粹的运动变化。此外,先前的研究中没有明确研究以运动控制著称的投射到黑质网状部(SNr)的 dSPNs。我们的数据表明,Kremen1 和 Tshz1 dSPNs 代表了在很大程度上不同的类似斑片的 dSPN 亚型。虽然 Kremen1+ dSPNs 通过向黑质网状部(SNr)的投射来抑制运动,但投射到黑质网状部(SNr)的 Tshz1+ SPNs 的作用仍不清楚。这些发现强调了未来的研究需要根据分子标记物和投射靶点明确识别神经元亚型。
Kremen1+ dSPN 的活动比 Calb1+ dSPN 的活动增加得晚得多,并且大多在运动开始后才增加,这表明它们不是发起运动,而是调节或终止运动。相比之下,Calb1+ dSPNs 在运动开始前就表现出活动升高,这与它们在运动发起中的作用一致。在运动结束时,与 Calb1+ dSPNs 相比,Kremen1+ dSPNs 表现出升高且呈上升趋势的神经元活动,这表明它们在终止运动和促进从运动状态到静止状态的转换中发挥作用。这与基底神经节参与状态转换调节的既定原则是一致的。对 Kremen1+ dSPNs 进行光遗传学激活缩短了运动持续时间并增加了静止时间,支持了它们在运动状态转换中的作用。
Aldh1a1 + 黑质纹状体 DANs 是背侧纹状体单突触输入的主要接受者,并与 dSPNs 形成相互支配关系。这个反馈回路可能有助于在运动控制和学习过程中调节多巴胺的释放和 SPN 的活动。斑片和基质 dSPNs 都支配 Aldh1a1+ DANs。值得注意的是,Kremen1 + 和 Calb1+ dSPN 轴突终末偶尔会与黑质网状部(SNr)中的 DAN 树突形成类似纹体小体 - 树突花束的结构,这种结构可能会影响背侧纹状体和黑质网状部(SNr)中的多巴胺释放。与这些体外研究一致,我们的体内记录显示,与刺激 Calb1+ dSPNs 相比,刺激 Kremen1+ dSPNs 对多巴胺释放的抑制更为明显,并且在停止刺激 Kremen1+ dSPNs 时观察到多巴胺释放反弹。
激活 Calb1+ dSPNs 最初会增加多巴胺的释放,这可能是由于通过抑制黑质网状部(SNr)中的小白蛋白神经元(PVNs)来解除对 DANs 的抑制,而小白蛋白神经元(PVNs)会持续性地抑制 DANs。相反,刺激 Kremen1+ dSPNs 会导致多巴胺释放受到更大程度的抑制,然后在刺激停止后出现反弹释放。这些对多巴胺释放的相反影响与它们各自的运动功能是一致的:Calb1+ dSPNs 促进运动,而 Kremen1+ dSPNs 终止运动。在 Aldh1a1+ DANs 中对 GABBR1 进行基因敲低消除了由 Kremen1+ dSPNs 诱导的运动抑制和刺激后反弹活动,证实了 GABBR1 介导的信号传导的关键作用。光纤光度测定法进一步表明,在 Aldh1a1+ DANs 中敲低 Gabbr1 减少了对 DANs 活动的抑制,并消除了在激活 Kremen1+ dSPN 后出现的反弹反应。
我们的研究表明,在分子层面不同的 dSPN 亚群在运动控制中发挥着特殊的作用。Calb1+ dSPNs 通过抑制黑质网状部(SNr)的抑制性输出来促进运动,而 Kremen1+ dSPNs 主要通过 GABBR1 介导的信号传导抑制 Aldh1a1+ DANs 来抑制运动。这些发现强调了分子标记物在剖析神经元回路机制中的重要性,并突显了基底神经节运动控制中不同 dSPN 亚群之间复杂的相互作用。
四、方法
01. 小鼠实验
所有小鼠研究均按照美国国立卫生研究院(NIH)下属的美国国立衰老研究所(NIA)内部研究计划的机构动物护理和使用委员会(IACUC)批准的指南进行。所有小鼠品系在 C57BL/6J 背景下均维持为杂合子。Kremen12A-Cre 基因敲入(KI)小鼠通过 CRIPSR/Cas9 方法在 C57BL/6J 品系中生成。Aldh1a1CreERT2 基因敲入小鼠的生成方法如先前所述。Nr4a1–eGFP转基因小鼠购自突变小鼠资源与研究中心(MMRRC)。Calb1IRES2-Cre 小鼠和 Ai14购自一家实验室。A2a2A-Flp 基因敲入小鼠由 [研究人员] 格芬博士和美国国立精神卫生研究所(NIMH)的啮齿动物转基因核心实验室生成。所有实验均使用了雌性和雄性小鼠。用于病毒注射的小鼠年龄在 2 至 4 个月之间。小鼠以 2 至 5 只为一组,饲养在 12 小时光照 / 12 小时黑暗的循环环境中,自由饮水并给予常规饮食。所有行为学实验均在光照周期内进行。实验前,同窝小鼠被随机分配到不同的组中。
02. Kremen1 2A-Cre 基因敲入小鼠的生成
Kremen12A-Cre 基因敲入小鼠使用 CRIPSR/Cas9 方法在 C57BL/6J 品系中生成。构建了一个包含 2A 核糖体跳跃序列、Cre DNA 重组酶序列以及两侧为 Kremen1 小鼠基因组 DNA 序列的供体质粒。在序列为 GTGGGCTTCAGTCACTCACG AGG 的 gRNA 引导下,将该 2A-Cre DNA 片段插入到 Kremen1 基因座终止密码子后的第 9 外显子中。获得了一只创始小鼠,并通过测序确认了正确的基因组修饰。
03. 激光捕获显微切割和 RNA 测序
对 1 个月大的 Nr4a1-eGFP 转基因小鼠实施二氧化碳安乐死,随后迅速断头。立即解剖大脑并在−80°C 下保存。在−20°C 下对冷冻的大脑进行冰冻切片,将切片安装在特定的膜框架载玻片上。根据诸如胼胝体、侧脑室和伏隔核等解剖标志来确定背侧纹状体的位置。使用带有荧光照明的显微切割系统,将 Nr4a1-eGFP 转基因小鼠背侧纹状体中 eGFP 阳性的岛状结构小心地分离到激光捕获显微切割(LCM)大盖片上,并将其指定为 “斑片”,同时将类似大小的周围组织也分离到大盖片上,并指定为 “基质”。
使用特定的分离试剂盒从数百个盖片中提取并纯化总 RNA,随后按照制造商的方案,使用无 RNase 的 DNase 去除基因组 DNA。使用 NanoDrop 分光光度计对 RNA 进行定量,并使用 Bioanalyzer RNA 6000 pico 分析试剂盒评估 RNA 的完整性。只有核糖体完整性数值(RIN)为 7 或更高,显示出高完整性的 RNA 样本才被选用于后续的斑片和基质 RNA 测序文库制备。
根据制造商的方案,使用特定的文库制备试剂盒从纯化的 RNA 制备 cDNA 文库。在特定平台上进行测序之前,使用 Bioanalyzer DNA 1000 分析试剂盒评估文库的质量。使用标准的流程生成 Fastq 文件。由 Ensembl 注释的转录本丰度使用 Salmon 以非比对模式进行定量,并使用 Tximport 软件包(Bioconductor)估计基因水平的计数。按照先前建立的程序进行计数的标准化和后续的数据分析。纹状体组织 RNA 测序的登录号为 PRJNA870469。
04. RNA 原位杂交和图像分析
使用 RNA 原位杂交技术(RNAscope)检测成年 C57BL/6J 小鼠背侧纹状体中 Drd1、Drd2、Kremen1 和 Tshz1 mRNA 的表达。对于组织制备,小鼠用二氧化碳麻醉后迅速断头。将大脑在干冰上新鲜冷冻,并在切片前储存在−80°C。使用冷冻切片机收集纹状体切片(12μm),并储存在−80°C 直至进行处理。
RNAscope 实验按照 RNAscope 多重荧光试剂试剂盒 v2 用户手册的说明进行。将针对 Drd1、Drd2、Kremen1 和 Tshz1 的探针应用于脑切片。使用配备 20× 或 40× 镜头的激光扫描共聚焦显微镜采集荧光图像。选择前囟坐标约为 1.34mm、0.92mm、0.5mm、0.08mm 和 -0.34mm 的区域进行图像分析。
使用 Imaris 软件(v10.0.0)分析 RNAscope 图像。以艾伦脑图谱为参考,创建背侧和腹侧纹状体的表面模型。通过勾勒 Kremen1+ SPN 簇(至少 5 个 SPN)来定义空间斑片,并且空间斑片内 Kremen1+ SPN 的密度至少为 200 个细胞 /mm²。使用独特的参数创建各个通道(即 Drd1、Drd2、Kremen1、Tshz1 和 DAPI)的表面模型,并将其保存并应用于同一批次的所有图像。在后续的 RNAscope 实验中进行了一些微调,以提高定量的准确性。纹状体中的 DAPI 表面通过 Drd1(dSPNs)的平均强度和 Drd2(iSPNs)的平均强度进行过滤。这些 Drd1 + 和 Drd2 + 细胞通过与 Kremen1 的重叠体积比进一步过滤,以分别定量斑片 dSPNs 和斑片 iSPNs。对 Tshz1 进行 RNAscope 分析的方式类似,通过与 Tshz1 表面的重叠体积比过滤 Drd1 + 和 Kremen1 + 细胞。所有数据点均表示为每只小鼠两个半球纹状体切片的平均值。
由于使用 RNAscope V2 试剂最多只能同时染色三个探针的限制,我们在图 1d 中使用 Kremen1、Drd1 和 Drd2 探针染色不同批次的大脑,在补充图 S1 中使用 Kremen1、Tshz1 和 Drd1 探针染色。数量上的细微差异是因为数据来自两个不同批次的大脑,并且由不同的人员进行计数。
05. 免疫组织化学
小鼠用戊巴比妥麻醉,然后按照先前所述,经心脏灌注预冷的 PBS,接着灌注 4% 的多聚甲醛(PFA)溶液。将大脑在 4°C 下于 4% 的 PFA 中过夜保存,然后转移到 30% 的 PBS 缓冲蔗糖溶液中至少保存 2 天,然后进行切片。使用冷冻切片机收集一系列冠状切片(40μm),并将其储存在 4°C 的 PBS 中。将切片在室温(RT)下用 10% 的正常驴血清 + 0.5% 的牛血清白蛋白 + 0.3% 的 Triton 封闭 1 小时。接下来,将切片与一抗在 4°C 下孵育一到两个晚上。然后将切片用 PBS 洗涤(3 次,每次 10 分钟),并在室温下与荧光二抗孵育 1 小时。在一些实验中,将切片再用 PBS 洗涤两次,用 DAPI(40, 6 - 二脒基 - 2 - 苯基吲哚)(在 PBS 中浓度为 0.5mg/ml)孵育 1 分钟。用 PBS 洗涤(5 分钟)后,将切片安装在涂有明胶的载玻片上,并用封片剂封片。使用激光扫描共聚焦显微镜拍摄图像。用于免疫染色的一抗包括兔单克隆抗酪氨酸羟化酶(TH)抗体、鼠单克隆抗 TH 抗体、鸡多克隆抗 TH 抗体、兔抗 μ- 阿片受体(MOR)抗体、鸡多克隆抗绿色荧光蛋白(GFP)抗体、鼠多克隆抗红色荧光蛋白(RFP)抗体、豚鼠抗小白蛋白(Parvalbumin)抗体、兔抗生长抑素 - 14(Somatostatin-14)抗体、山羊抗胆碱乙酰转移酶(ChAT)抗体、兔抗离子钙结合衔接分子 1(Iba1)抗体、兔抗胶质纤维酸性蛋白(GFAP)抗体、山羊抗 CD13 抗体和鼠单克隆抗 GABAB 抗体。根据所需的荧光颜色,使用适当的荧光素偶联二抗。
06. Gabbr1 基因敲低小鼠中的神经元计数
对 Gabbr1 基因敲低(KD)小鼠和对照(Ctrl)小鼠的中脑冠状切片(厚度为 40μm,每只小鼠大约有四个切片,范围从前囟 -2.70mm 到 -3.80mm)用抗 TH、抗 ALDH1A1 和抗 GABBR1 抗体进行染色,以便进行定量分析。使用激光扫描共聚焦显微镜,以 ×20 物镜拍摄黑质(SN)的单层图像。使用 ImageJ 软件(v1.53t)对 ALDH1A1+/TH + 和 ALDH1A1-/TH + 多巴胺能神经元中 GABBR1 受体阳性神经元的百分比进行鉴定。根据先前描述的方法手动勾勒黑质致密部(SNc)区域。
07. 病毒载体
以下腺相关病毒(AAV)载体购自一家公司:AAV9-hSyn-DIO-hM4D (Gi)-mCherry(#44362)、AAV9-hSyn-DIO-mCherry(#50459)、AAV1-EF1a-double floxed-hChR2 (H134R)-EYFP(#20298)、AAV1-hSyn-hChR2 (H134R)-EYFP(#26973)、AAV8-hSyn-Con/Fon-hChR2 (H134R)-EYFP(#55645)、AAV8-hSyn-Con/Fon-EYFP(#55650)、AAV1-Ef1a-DIO-EYFP(#27056)和 AAV1-syn-FLEX-jGCaMP8s(#162377)。AAV2/9-hSyn-DIO-GRAB-rDA3m 由一家公司生产。AAV9-FLEX-SaCas9-U6-sgGabbr1 由一家公司包装。AAV9-CMV-NLS-SaCas9-3XHA-sNRPpa-U6-Basal-empty 由一家公司包装。
08. pAAV-FLEX-SaCas9-U6-sgGabbr1 的构建
从 UCSC 基因组浏览器数据库(http://genome.ucsc.edu/)中检索 Gabbr1 基因的参考序列,随后使用小鼠基因组信息学(MGI)数据库进行外显子的鉴定和比对。然后选择最靠近 5' 端的常见编码外显子,并将该序列上传到 CRISPOR 网站(http://crispor.org),以识别潜在的 sgRNA 和 PAM 序列。合成了三个 Gabbr1 sgRNA 作为短寡核苷酸,正向引物带有 5'-CACC-3' 突出端,反向引物带有 5'-AAAC-3' 突出端,便于无缝整合到 pX601-AAV-CMV;NLS-SaCas9-NLS-3xHA-bGHpA;U6;BsaI-sgRNA 载体中,该载体由 [研究人员] 张锋博士提供(Addgene 质粒编号# 61591)。使用引物 TAACCACGTGAGGGCCTATTTC 进行桑格测序,确认了 Gabbr1 sgRNA 的插入。
将小鼠 Neuro-2a(N2a)细胞系在补充有 10% 胎牛血清的杜氏改良伊格尔培养基(DMEM)中,于 37°C、5% 二氧化碳的培养箱中培养。按照制造商的方案,使用特定的转染试剂盒将质粒 pX601-AAV-CMV;NLS-SaCas9-NLS-3xHA-bGHpA;U6;sgGabbr1 载体转染到细胞中。然后收获细胞,使用 Guide-it 突变检测试剂盒(货号 631443)进行基于 PCR 的基因组编辑诱导突变鉴定。序列为 CACCGCGCCACACTCCACAATCCCAC 的 sgGabbr1 在 SaCas9 作用下表现出高效的基因组编辑效率,因此被选择用于进一步整合到 pAAV-Flex-SaCas9-U6-sgDaglb 载体中。使用引物 5’-TAACCACGTGAGGGCCTATTTCCCATGATT 和 5’-CGCTCGGTCCGAAAAATCTCGCCAACAAGTT 扩增包含 sgGabbr1 的片段,该片段在 PmlI 和 RsrII 识别位点处替换了质粒 pAAV-Flex-SaCas9-U6-sgDaglb 中的 sgDalgb。桑格测序证实了所得 pAAV-Flex-SaCas9-U6-sgGabbr1 质粒中存在 sgGabbr1。
转自:东莞富临医疗科技有限公司- 本文固定链接: https://maimengkong.com/kyjc/1962.html
- 转载请注明: : 萌小白 2025年7月5日 于 卖萌控的博客 发表
- 百度已收录
