淹水胁迫对植物的生长发育有负面影响,研究耐涝机制对分子育种的研究具有重要意义。中国农业科学院郑州果树研究所研究团队选取猕猴桃耐涝基因型KR5为研究材料,结合三代SMRT测序和二代测序进行了转录组分析,揭示了猕猴桃的耐涝机制,并在《International Journal of Molecular Sciences》(IF=6.208/化学2区)期刊上发表了题为“Full-Length Transcriptome and RNA-Seq Analyses Reveal the Mechanisms Underlying Waterlogging Tolerance in Kiwifruit (Actinidia valvata)”的文章。
奥维森提供了三代全长和二代转录组测序及分析服务。

01
研究背景
在淹水的土壤中,根组织被淹没在水中,导致根际周围的氧气浓度迅速下降。缺氧限制了根部的有氧呼吸,导致能量不足,对植物生长发育造成伤害。猕猴桃具有耐涝性,然而,这一特征背后的机制尚不清楚。
02
研究方法
实验材料:对萼猕猴桃KR5基因型植株,对淹水胁迫具有高度耐受性
处理:淹水胁迫0、12、24、72h(0h作为对照)(n=3)
方法:生理指标测定、RNA-seq、Iso-Seq、qRT-PCR
03
研究结果
1、Iso-seq 注释分析
共获得130246个unigenes,123863个(95.10%)unigenes在NR中得到了注释,54850个(42.12%)unigenes在5个数据库(NR、NT、GO、KEGG、KOG)中的到了注释。
GO注释显示,在三大分类中,unigenes注释个数分别为top3的是生物过程中的“代谢过程”、“细胞过程”和“单一生物体过程”,细胞成分中的“细胞”、“细胞部分”和“细胞器”,分子功能中的“结合”、“催化活性”和“转运体活性”。
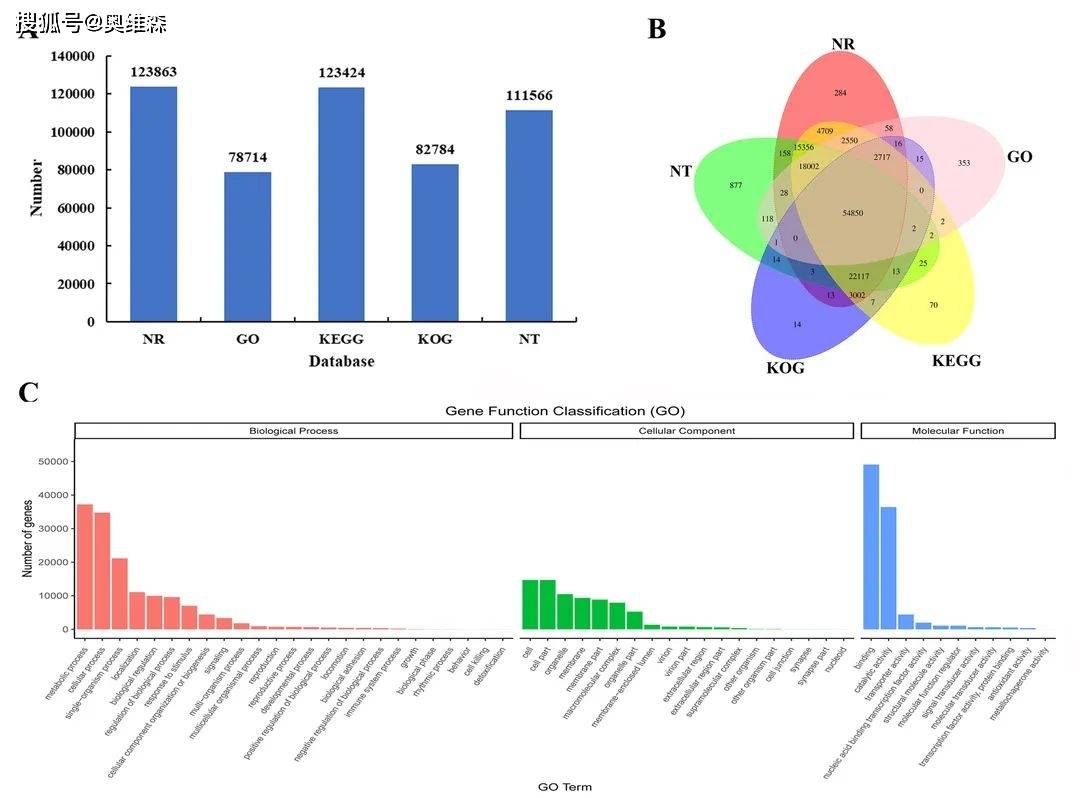 图1 Iso-seq注释结果
图1 Iso-seq注释结果
2、DEGs分析
随着时间的推移,对照和淹水处理之间的上调和下调DEGs的数量逐渐增加。在不同的淹水胁迫时期,分别有1838个和676个共同上调和下调的DEGs。此外,在淹水12、24和72 h 后,分别特异性表达了310个(81个上调和229 个下调)、2165个(1683个上调和482个下调)和15108个(6575个上调和8533个下调)DEGs。淹水12h后,共表达上调和下调DEGs的百分比最高。结果表明,在KR5根系中,早在淹水12h就刺激了保守的转录本调整,并且在淹水胁迫24h或72h后诱导了动态转录组变化。
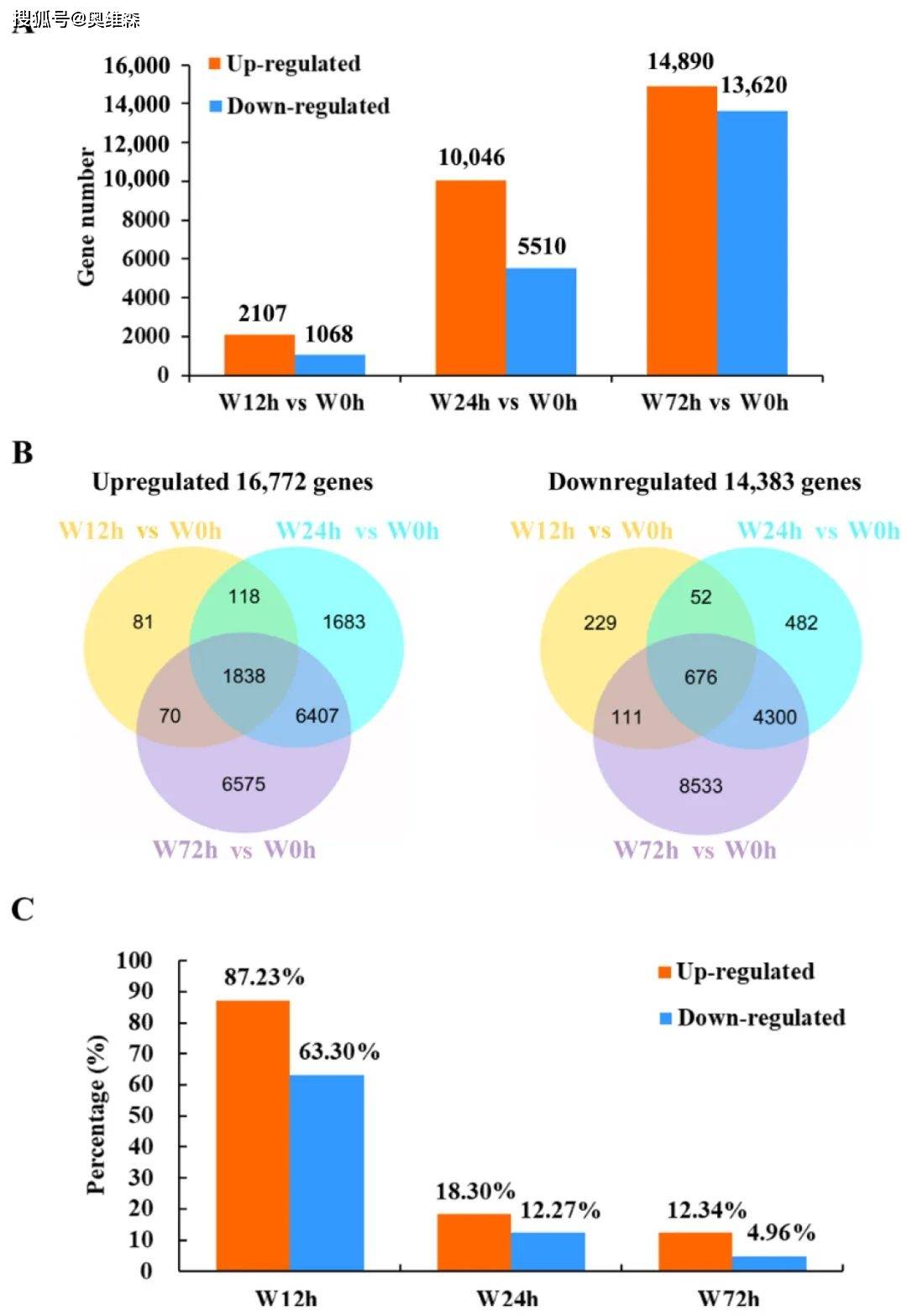 图2 Iso-seq差异分析
图2 Iso-seq差异分析
3、共表达DEGs的KEGG分析
对共表达DEGs进行KEGG富集分析。上调DEGs显著富集的途径包括“淀粉和蔗糖代谢”、“果糖和甘露糖代谢”、“精氨酸和脯氨酸代谢”、“氨基酸生物合成”、“氮代谢”和“过氧化物酶体”。下调DEGs显著富集的途径包括“淀粉和蔗糖代谢”、“精氨酸和脯氨酸代谢”途径。结果表明,KR5根系对不同持续时间的淹水胁迫的反应主要涉及碳水化合物和氨基酸代谢的调节以及活性氧的清除。
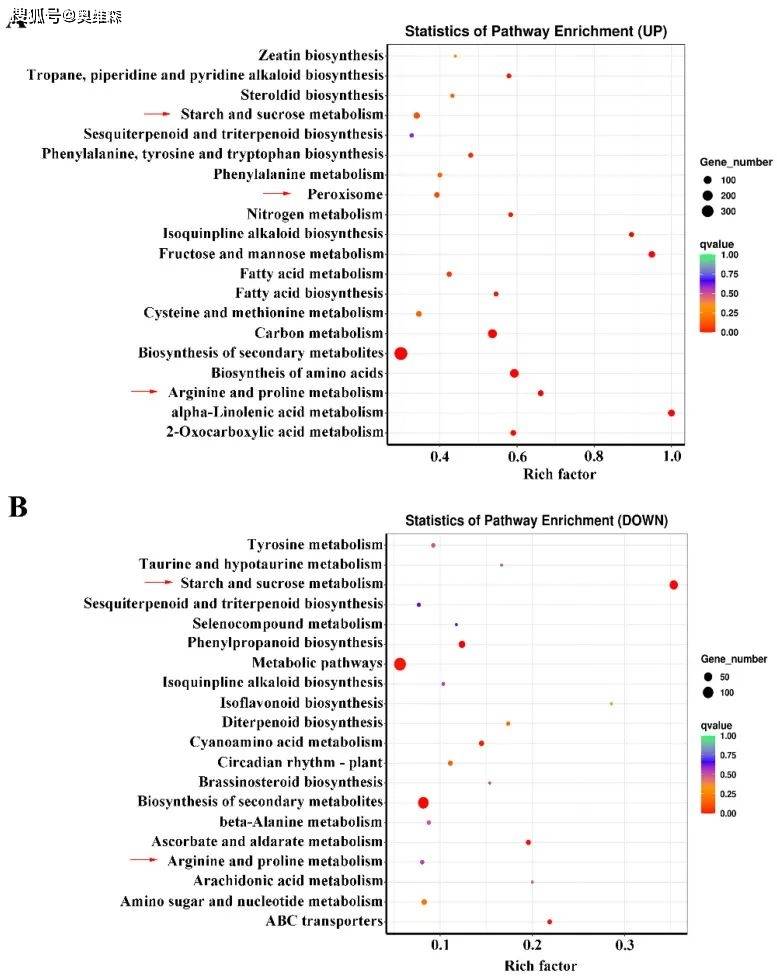 图3 共表达DEGs的KEGG富集分析
图3 共表达DEGs的KEGG富集分析
此外,有29个共表达上调的DEGs在“脂肪酸代谢”和“脂肪酸生物合成”途径富集。29个DEGs的热图分析表明,其中11个DEGs的表达水平在淹水胁迫下比其他DEGs的表达水平更高。表明脂肪酸和脂质代谢也在KR5根系响应淹水胁迫中发挥了作用。
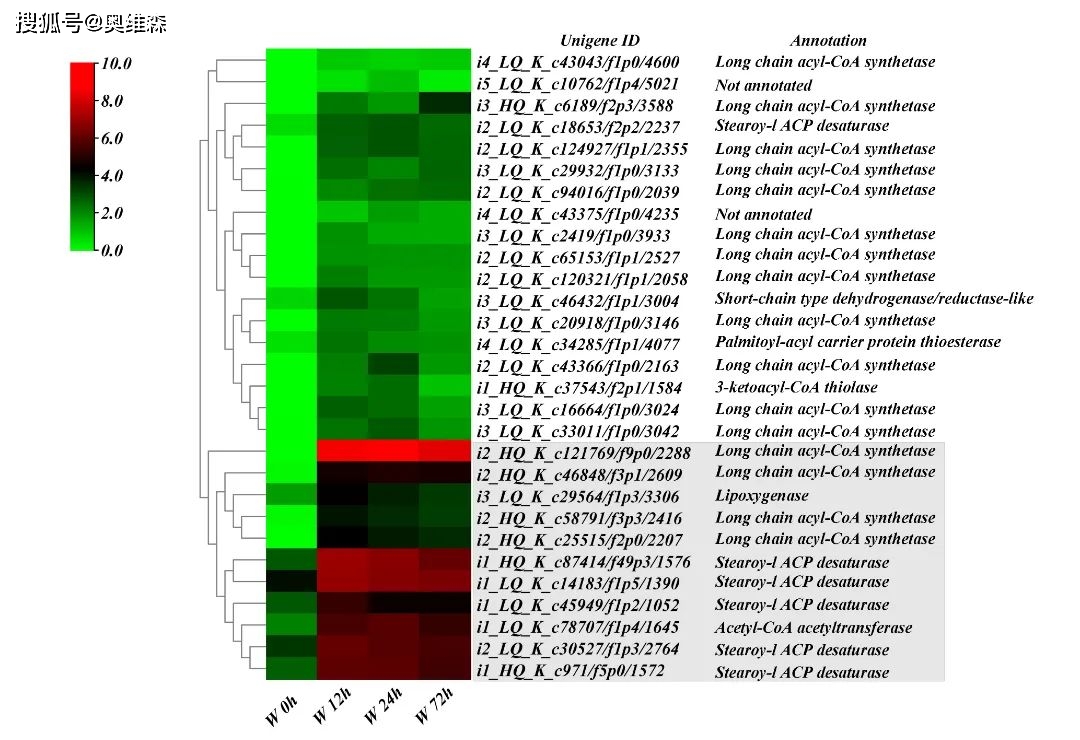 图4 29个DEGs的热图分析
图4 29个DEGs的热图分析
在“淀粉和蔗糖代谢”途径中,分别有51和53个DEGs上调和下调。上调DEGs编码的果糖激酶(FK)、UTP-葡萄糖-1-磷酸尿苷转移酶(UGP)、葡萄糖-6-磷酸异构酶(PGI)、海藻糖-6磷酸合成酶(TPS)和海藻糖磷酸磷酸酶(TPP)参与己糖和海藻糖代谢。下调DEGs编码的β-葡萄糖苷酶、内切葡聚糖酶、α-1,4-葡聚糖磷酸化酶(glgP)、ADP-葡萄糖焦磷酸化酶(glgC)、可溶性淀粉合酶(SSS)、颗粒结合淀粉合酶(GBSS)和淀粉分支酶(SBE)参与纤维素降解和淀粉代谢。结果表明在转录水平上,KR5根中的碳水化合物代谢在淹水胁迫下得到了调整。
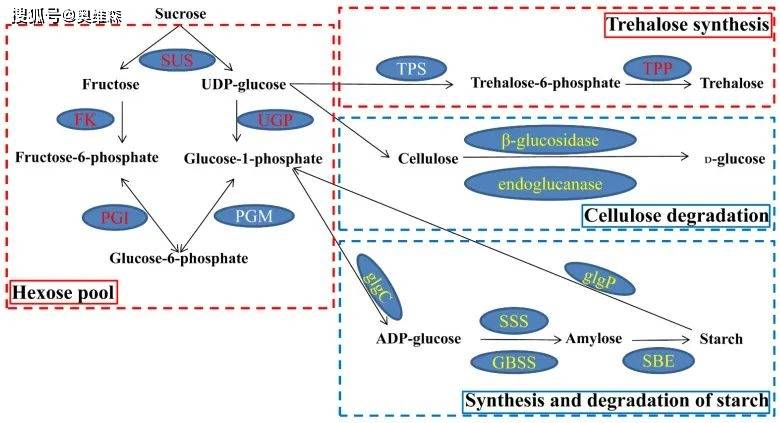 图5 共表达的DEGs参与“淀粉和蔗糖代谢”途径
图5 共表达的DEGs参与“淀粉和蔗糖代谢”途径
4、淹水胁迫下的碳水化合物代谢
与对照组相比,淹水胁迫12h和24h后蔗糖含量显著降低,淹水胁迫72h后蔗糖含量显著升高。蔗糖降解为6-磷酸海藻糖 (T6P) 的合成提供了底物,该过程由TPS催化。淹水胁迫下KR5根系中T6P含量略高于对照,且TPS活性显著高于对照。β-葡萄糖苷酶是一种负责纤维素降解的酶,淹水12或72h后,KR5根系的β-葡萄糖苷酶活性略低于对照,淹水24h后显著高于对照。结果表明,KR5根系对淹水的反应是通过调节蔗糖、T6P和纤维素代谢来实现的。
5、淹水胁迫下的乙醇发酵
乙醇脱氢酶(ADH)是厌氧发酵的标志物。在淹水胁迫下,KR5根系中编码ADHs的DEGs转录水平上调。RNA-Seq结果显示,在淹水胁迫下,i1_LQ_K_c67155/f1p0/1459(ADH1)和i1_LQ_K_c38965/f1p0/1342(ADH2)的表达水平最显著上调。通过qRT-PCR验证了这两种ADHs在淹水胁迫下的上调,淹水胁迫下ADH活性显著高于对照组。结果表明,在淹水胁迫下,KR5根系的乙醇发酵被激活。
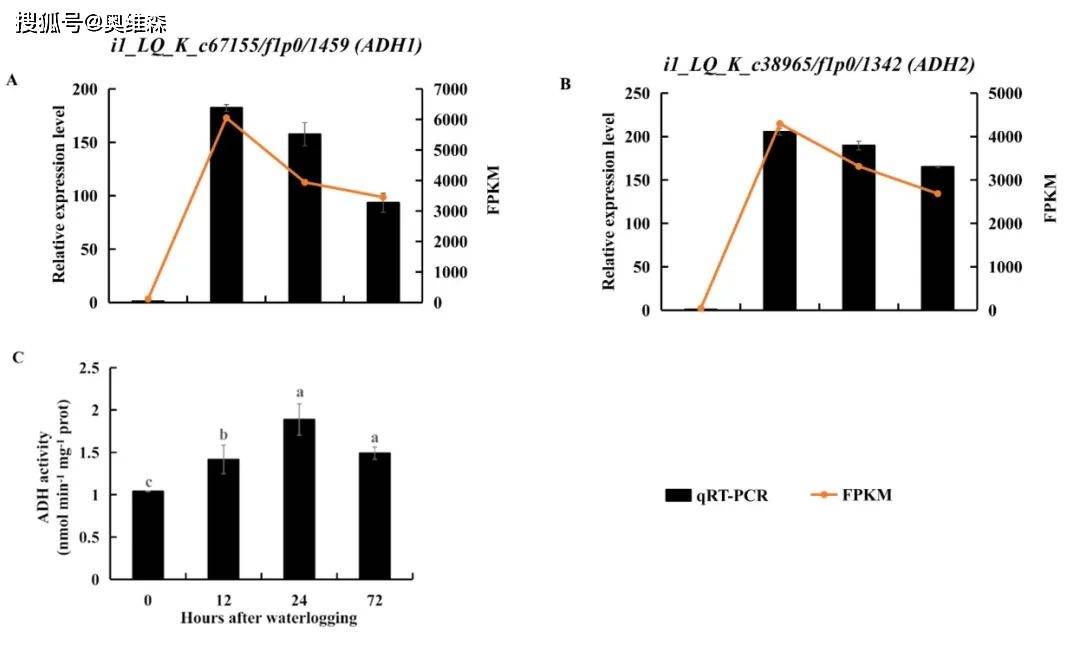 图7 淹水胁迫下KR5根系中编码ADH的两种DEGs表达水平和ADH活性的变化
图7 淹水胁迫下KR5根系中编码ADH的两种DEGs表达水平和ADH活性的变化
6、淹水胁迫下的游离氨基酸代谢
淹水胁迫下16种氨基酸的总含量显著高于对照组。谷氨酸家族氨基酸比例在淹水12h后增加,在淹水72h后下降。丙酮酸家族的氨基酸比例在淹水胁迫72h内持续增加,天冬氨酸、丝氨酸和芳香族氨基酸家族的氨基酸比例在淹水胁迫72h内均下降。表明KR5根系通过调节游离氨基酸水平来应对淹水胁迫。
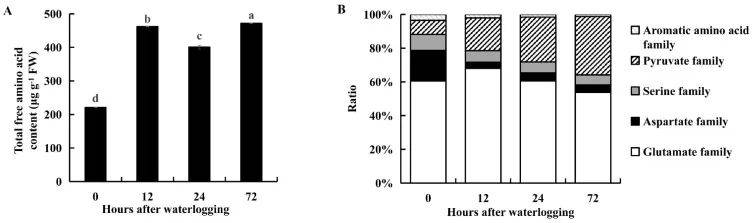 图8 总游离氨基酸含量的变化
图8 总游离氨基酸含量的变化
7、与丙氨酸和谷氨酸代谢有关的酶和DEGs
丙氨酸氨基转移酶(AlaAT)通过消耗丙酮酸和谷氨酸来催化丙氨酸的形成。与对照相比,淹水胁迫下KR5根系的AlaAT活性显著增加。AlaATs编码的DEGs转录水平在淹水胁迫下大部分上调。RNA-Seq和qRT-PCR结果均显示,在淹水胁迫下,i2_HQ_K_c171325/f20p0/2198和i2_HQ_K_c146831/f7p5/2147的转录水平显著提高。
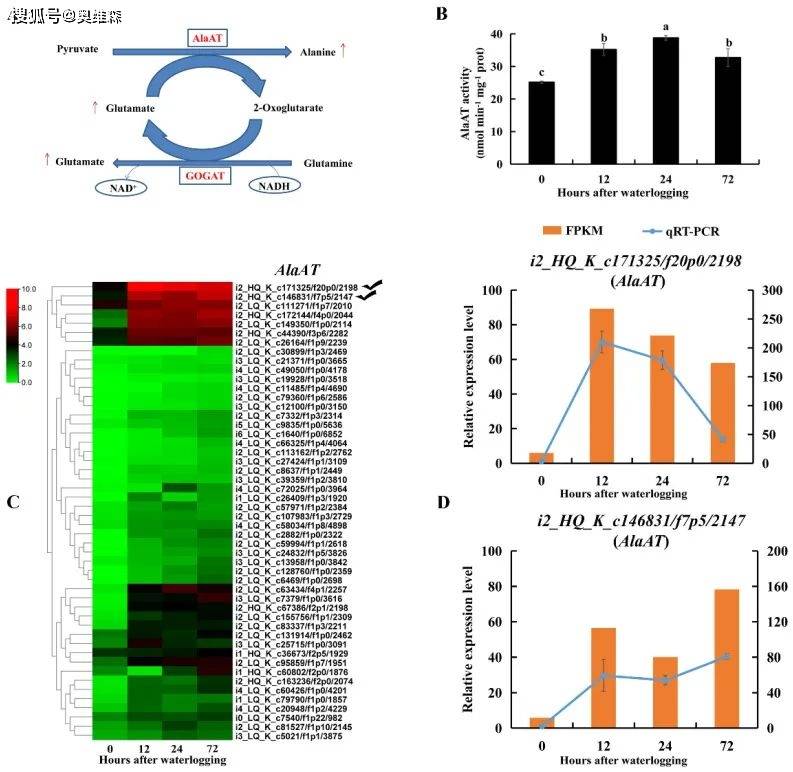 图9 淹水胁迫下KR5根系AlaAT转录水平和酶活性的变化
图9 淹水胁迫下KR5根系AlaAT转录水平和酶活性的变化
淹水胁迫下的谷氨酸含量显著高于对照组。烟酰胺腺嘌呤二核苷酸依赖性谷氨酸合成酶(NADH-GOGAT)通过将谷氨酰胺基转移到2-酮戊二酸来催化谷氨酸的形成。在淹水胁迫72h内,根系NADH-GOGAT活性显著增强,编码NADH-GOGAT的DEGs转录水平也上调。RNA-Seq和qRT-PCR结果显示,在淹水胁迫下,i3_LQ_K_c32001/f1p1/3012和i4_LQ_K_c24284/f1p0/4938的转录水平明显提高。表明NADH-GOGAT/AlaAT循环与淹水胁迫下KR5根系的丙氨酸和谷氨酸代谢有关。
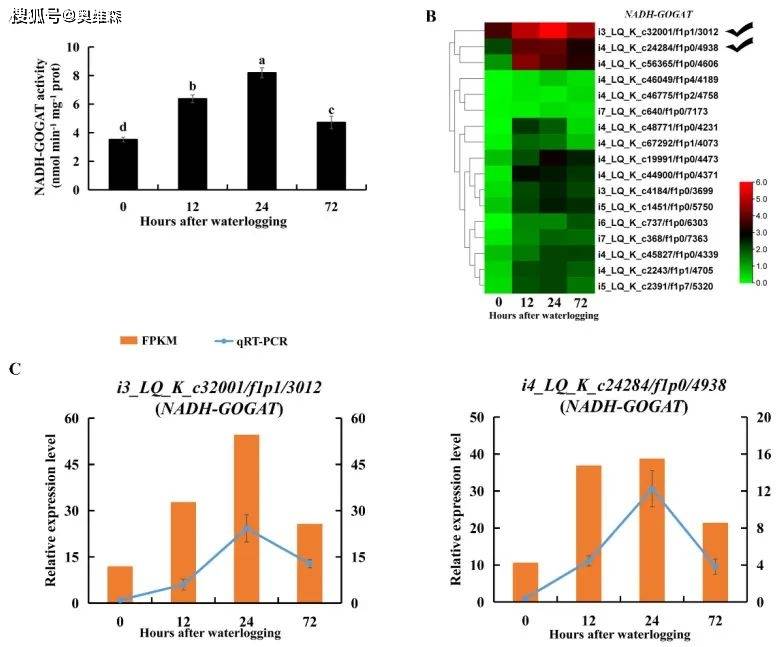 图10 淹水胁迫下KR5根系NADH-GOGAT转录水平和酶活性的变化
图10 淹水胁迫下KR5根系NADH-GOGAT转录水平和酶活性的变化
8、与活性氧清除相关的酶和DEGs
超氧化物歧化酶(SOD)催化超氧阴离子歧化为过氧化氢(H2O2)。KR5根系总SOD活性在淹水72h内显著降低。编码Mn-SOD的DEGs在淹水胁迫下表达上调,编码Cu/Zn-SOD和Fe-SOD的DEGs在淹水胁迫下表达下调。RNA-Seq和qRT-PCR结果表明,Mn-SODs(i1_LQ_K_c14090/f1p1/1743和i2_HQ_K_c5632/f4p6/2696)的表达水平在淹水胁迫下明显提高。
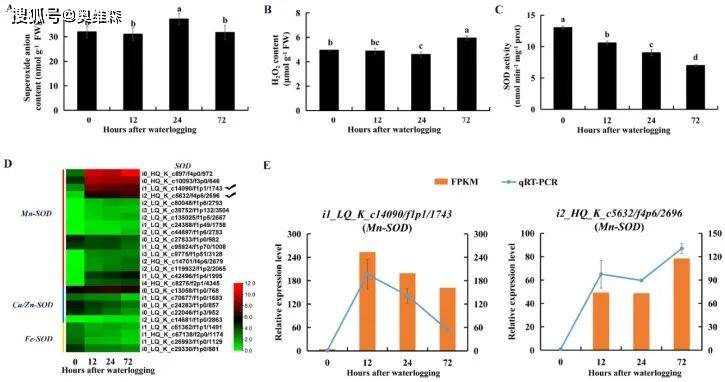 图11 淹水胁迫下KR5根系超氧阴离子和H2O2含量、SOD活性及SODs表达模式的变化
图11 淹水胁迫下KR5根系超氧阴离子和H2O2含量、SOD活性及SODs表达模式的变化
过氧化物酶(POD)和过氧化氢酶(CAT)可以将H2O2还原为水和氧气。与对照相比,淹水12h和24h后H2O2含量略有下降,然后在淹水72h后显著增加。POD活性在淹水72h内显著增加,编码POD的DEGs大部分下调,然而POD基因(i1_LQ_K_c68121/f11p1/1342和i1_HQ_c28263/f2p2/1591)的表达水平在淹水胁迫下仍然明显提高。淹水24h后CAT活性显著升高,与对照相比,编码CAT的DEGs在淹水胁迫72h内表达下调。结果表明KR5根系中的三种抗氧化酶参与了对淹水胁迫的响应。
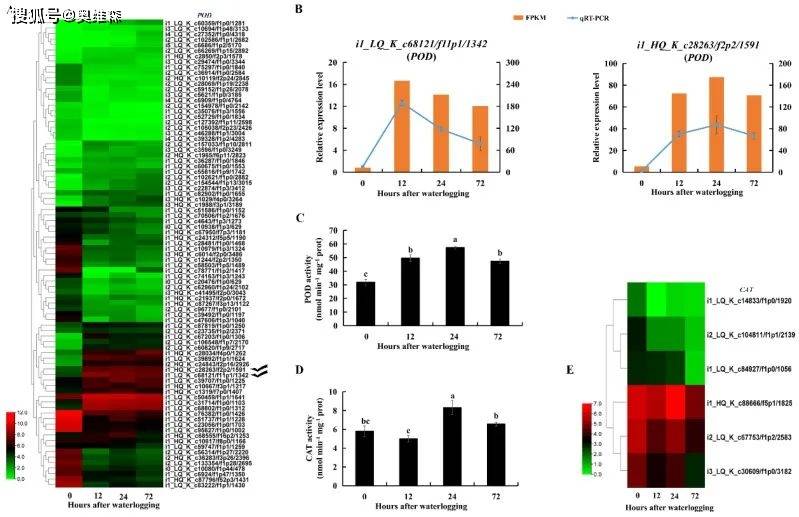 图12 淹水胁迫下KR5根系POD和CAT活性的变化及PODs和CATs的表达模式
图12 淹水胁迫下KR5根系POD和CAT活性的变化及PODs和CATs的表达模式
9、鉴定编码TFs的Unigenes或DEG
总共有9100个Unigenes被预测为TFs。前30个TFs家族包括C3H、SNF2、bHLH、MYB相关、bZIP、B3-ARF、WRKY、C2H2和AP2/ERF−ERF。其中有143个上调和42个下调的共表达DEGs被注释为TFs。根据其在淹水胁迫下的表达模式,上调的TFs进一步分为4组(a、b、c和d),在d组中,DEGs的表达水平在淹水胁迫下显著增加,这些TFs主要集中于LOB(10)、AP2/ERF-ERF(8)、Trihelix(5)和C3H(2)家族中。下调的TFs主要集中于NF-YA(6)、bHLH(5)、MYB相关(5)、C3H(3)、AP2/ERF-ERF(2)和B3-ARF(2)家族。结果表明TFs在KR5根系对淹水胁迫的适应中起调节作用。
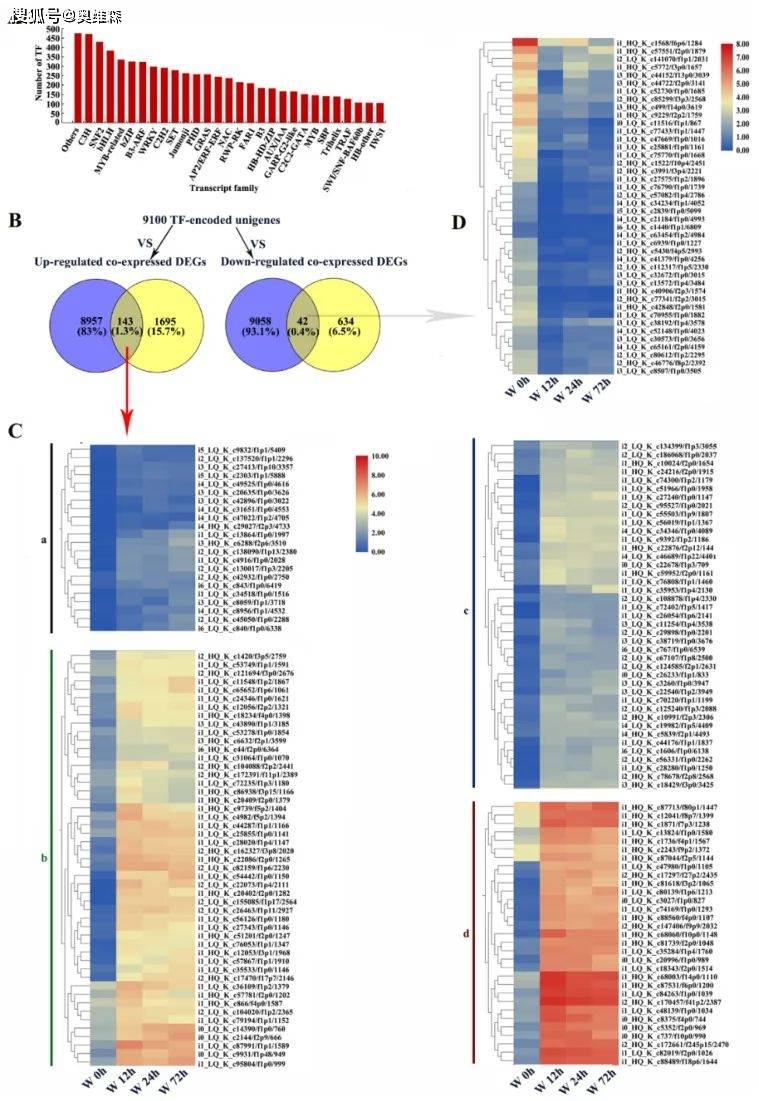 图13 识别编码转录因子(TF)的unigenes或DEGs
图13 识别编码转录因子(TF)的unigenes或DEGs
10、WGCNA分析挖掘Hub基因并通过qRT-PCR验证
根据12个独立样本(3个重复,4个淹水持续时间)的FPKM值对所有DEGs进行排序。在删除没有注释的DEGs后,WGCNA对值在500以上的DEGs进行评估。识别出7个模块,每个模块包含40-1070个DEGs。以ADH、TPS、AlaAT和POD的活性水平以及丙氨酸、精氨酸和H2O2的含量作为表型数据,计算性状与模块的相关性。蓝色模块中除H2O2外,其余相关系数均在0.67到0.99之间。选择蓝色模块中排名前60位的hub基因构建基因网络。在这个网络中,一些参与糖酵解和发酵(ADH、PDC和SUS)、丙氨酸代谢(AlaAT)、ROS裂解(POD)以及编码TFs(ERF、bHLH和LOB)的基因高度共表达。结果表明,在TFs的调控下,与碳水化合物和氨基酸代谢以及ROS裂解相关的几个基因在淹水胁迫下的KR5根系中显著上调。此外,qRT-PCR结果显示hub基因的表达模式与RNA-Seq数据中观察到的相似,证实了RNA-Seq结果的有效性。
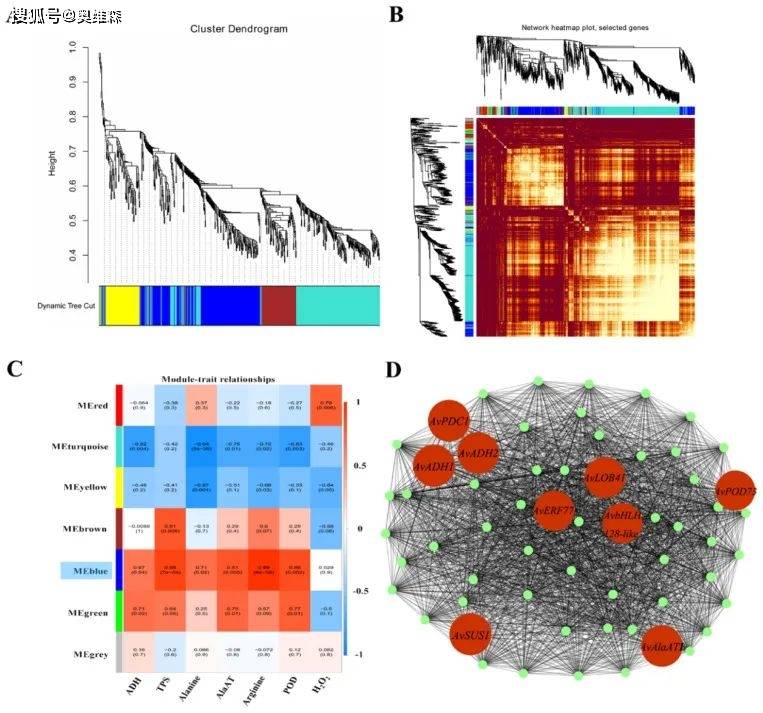 图14 共表达网络模块的识别
图14 共表达网络模块的识别
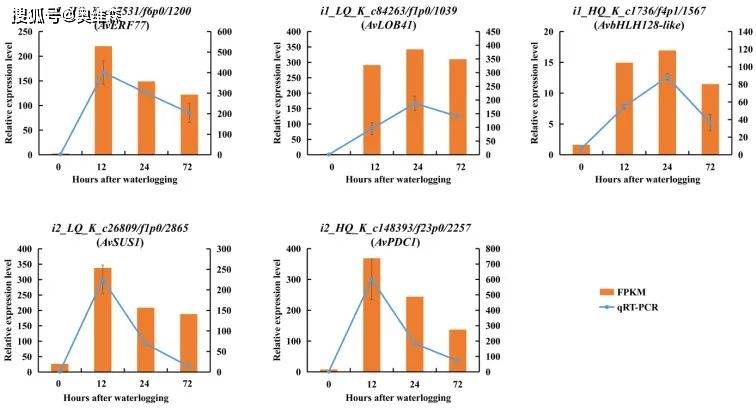 图15 hub基因qRT-PCR验证
图15 hub基因qRT-PCR验证
04
研究结论
将从头测序与PacBio Iso-Seq相结合,获得了耐涝猕猴桃KR5的全长unigenes。KR5根系通过调节碳水化合物和氨基酸代谢以及清除ROS来响应淹水胁迫。我们鉴定了几个与淹水胁迫相关的基因,并描述了相关酶和代谢物的动态变化。WGCNA结果揭示了一个与淹水反应相关的候选基因共表达网络。总的来说,研究结果扩展了我们对耐涝猕猴桃基因型中淹水胁迫诱导调控机制的理解。
转自:奥维森科技
- 本文固定链接: https://maimengkong.com/zu/1996.html
- 转载请注明: : 萌小白 2025年7月27日 于 卖萌控的博客 发表
- 百度已收录
