
大黄为蓼科植物掌叶大黄Rheum palmatumL.,唐古特大黄R. tanguticumMaxim. ex Balf.或药用大黄R. officinaleBaill.的干燥根及根茎,具有利湿退黄、凉血解毒、逐淤痛经、清热泻火等功效。现代研究表明,大黄酸、大黄素、大黄酚、大黄素甲醚和芦荟大黄素5种蒽醌类物质是大黄主要的药效成分,具有泻下、抗菌、抗炎、抗肿瘤、利尿、抗凝血、抗衰老、免疫调节等多种药理作用[1-2]。由于蒽醌类物质在医药和生物领域的重要作用,如何高效、快速地获得蒽醌类物质,提高植物蒽醌类物质的合成效率,已经成为中药资源学研究的热点方向。所以研究植物体内的蒽醌代谢路径及机制,对蒽醌类物质的高效生产具有十分重要的意义。
植物体内蒽醌母核的生物合成主要涉及莽草酸(shikimic acid)和聚酮(polyketide)途径,而α-酮戊二酸(α-ketoglutarate,AKG)是莽草酸合成蒽醌的重要物质,因此也涉及三羧酸循环(TCA cycle)[3]。此外,由于中间产物共用,甲基赤藓糖醇(methylerythritol 4-phosphate,MEP)、甲羟戊酸(mevalonic acid,MVA)途径也参与其中[4]。莽草酸途径中分支酸盐和α-酮戊二酸经多步反应合成的邻琥珀酰苯甲酸酯(O-succinylbenzoate,OSB)构成蒽醌母核的A、B环,而来自MEP或MVA的异戊烯焦磷酸(isopentenyl diphosphate,IPP)经异构反应构成C环[5]。
在植物体的聚酮途径中,目前已知乙酰辅酶A或丙二酰辅酶A经III型聚酮合成酶(polyketide synthase,PKS III)催化形成八肽聚酮长链,再由聚酮环化酶(polyketide cyclase,PKC)催化得到蒽酮类,经氧化最终得到蒽醌母核。大黄素型蒽醌母核主要来自聚酮途径,而茜草型蒽醌母核主要来自莽草酸途径[6],这些途径之间又有中间产物的交叉。
药用植物蒽醌类成分生物合成途径及其调控研究刚起步,在虎杖、何首乌、荞麦等中有关键酶基因相关报道。莽草酸途径中异分支酸合成酶(ICS)催化蒽醌合成关键分叉点上的代谢物异分支酸的合成,聚酮途径PKSIII属于查耳酮合成酶家族(CHSs),已发现有CHS、二苯乙烯合酶、吖啶酮合酶、2-吡喃酮合酶和聚八酮合酶等[7]。目前对掌叶大黄的转录组报道较少,本研究利用Illumina Hiseq 2000高通量测序技术对掌叶大黄的根、根茎、叶分别进行行转录组测序,以期筛选出蒽醌类化合物生物合成途径相关的基因,为初步阐明蒽醌类化合物生物合成途径奠定基础。
1 仪器与材料
1.1 材料
供试材料一年生掌叶大黄来源于甘肃省陇南市 宕昌县,经陕西中医药大学王继涛高级实验师鉴定为掌叶大黄R. palmatumL.。植物总RNA提取试剂盒(RN53-EASYspin Plus多糖多酚/复杂植物RNA快速提取试剂盒)、反转录试剂盒(PC58-TRUE RT MasterMix)、荧光定量试剂盒(PC33-SYBR Green qPCR Mix)均购自北京艾德莱生物科技有限公司。
1.2 仪器与试剂
Waters 2695型高效液相色谱仪,Empower 3色谱工作站(Waters公司,美国),KQ-200KED型超声波清洗机(江苏昆山公司),实时荧光定量PCR仪(ABI StepOne7500,美国)。
对照品没食子酸(批号A0110)、儿茶素(批号A0158)、番泻苷B(批号A0127)、大黄酚-8- O - 葡萄糖苷(批号A0762)、大黄素-8- O - 葡萄糖苷(批号A1502)、芦荟大黄素(批号A0047)、大黄酸(批号A0043)、大黄素(批号A0044)、大黄酚(批号A0046)、大黄素甲醚(批号A0045)均购自成都曼斯特生物技术有限公司,质量分数均大于98%。
2 方法
2.1 掌叶大黄根、根茎、叶HPLC含量测定
取掌叶大黄植株若干,随机选择3株混合,3次平行取样。分别取掌叶大黄根、根茎、叶,用常规方法烘干。参考文献报道大黄HPLC含量测定方法[8]进行实验。色精密称取没食子酸、儿茶素、番泻苷B、大黄酚-8- O - 葡萄糖苷、大黄素-8- O - 葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,分别置于10 mL量瓶,用甲醇溶解并稀释至刻度,摇匀,得到质量浓度分别为224.0、710.0、656.0、172.0、234.0、79.0、77.0、28.0、48.0、27.0 μg/mL的对照品储备液。分别精密量取各对照品储备液1 mL,甲醇稀释10 倍,得到相应质量浓度的混合对照品储备液。4 ℃保存备用。各成分的线性回归方程参考文献报道[8]。
色谱柱为安捷伦C 18 (250 mm×4.6 mm,5 μm)色谱柱;流动相由甲醇(A)和0.2%磷酸水溶液(B)组成,梯度洗脱(0~5 min,5%~15% A;5~15 min,15%~30% A;15~25 min,30%~35% A;25~31 min,35%~42% A;31~46 min,42%~53% A;46~66 min,53%~68% A;66~75 min,68%~100% A;75~85 min,100% A),检测波长260 nm,柱温30 ℃,体积流量1.0 mL/min。进样量为10 μL。在上述色谱条件下分析,理论板数按各个成分计算均不低于5000,与相邻组分峰的分离度均大于1.5,色谱峰对称因子均在0.95~1.05。
2.2 总RNA提取
随机挑选3株掌叶大黄植株,分别称100 mg左右新鲜的掌叶大黄的根、根茎、叶,加液氮用研钵充分研磨,采用植物总RNA提取试剂盒从新鲜的植物组织中提取总RNA,用1.2%琼脂糖凝胶电泳检测总RNA完整性,用ND2000测定总RNA的A260/ A 280 的值,选择A260/ A 280 为1.8~2.0的总RNA进行反转录。
2.3 cDNA文库构建与序列组装
将掌叶大黄的根、根茎、叶的RNA由上海美吉生物医药科技有限公司构建测序文库,使用Illumina HiSeq 2000测序平台进行转录组双末端测序。
2.4Unigenes的功能注释
去除原始测序序列中含有接头及低质量的序列后,得到clean reads。使用Trinity [9]对clean reads进行拼接,然后使用序列聚类软件Corset [10]做进一步序列拼接和去冗余处理,得到Unigenes。将Unigenes序列与蛋白数据库Nr、Nt、Swiss-Prot、Pfam、KEGG、COG和GO做BLASTX比对(e值<0.000 01),得到Unigenes的蛋白功能注释信息。
2.5 基因表达差异分析
用RSEM软件[11]对各样品进行基因表达水平分析。统计每个样品比对到参考序列对应基因的reads数量(read count),并将其转换成FPKM(fragments per kilobase of exon model per million mapped reads)[12]。随后用TMM对基因表达水平分析中得到的read count数据进行标准化处理,再用DEGseq [13]筛选差异表达基因(differentially expressed gene,DEG),筛选标准为|log 2 (Fold Change)| >1且q-value<0.005。
2.6 差异表达基因
通过基因本体联合数据库(gene Ontology,GO)数据库(http://geneontology. org)和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(https://www. genome.jp/ kegg/pathway.html)进行GO和KEGG分析,利用GOseq和KOBAS(2.0)软件[14-15]分别对DEG进行GO和KEGG富集分析。
2.7qRT-PCR分析
选取转录组差异基因进行qRT-PCR分析,以验证转录组数据可靠性。qRT-PCR引物利用Primer Premier 6软件设计,引物列表详见表1。将样品RNA用艾德莱反转录试剂盒反转录为cDNA,以掌叶大黄的actin基因为内参,随后采用荧光定量PCR仪进行qPCR扩增。每个样品设置3个生物学重复,采用2−ΔΔ C t 法计算基因相对表达量[16]。
3 结果与分析
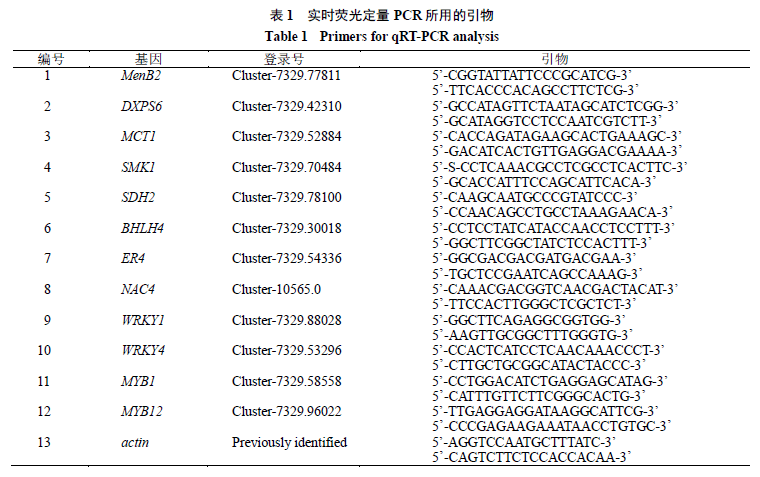
3.1 掌叶大黄中有效成分的测定
掌叶大黄根、根茎、叶HPLC色谱分析结果如表2所示,10种对照品在掌叶大黄根、根茎、叶中均可检测到,其中5种成分的含量在掌叶大黄的根、根茎、叶中差异不明显,如儿茶素、大黄素-8- O - 葡萄糖苷、芦荟大黄素、大黄酸、大黄素。大黄酚的含量分析表明,其在根、根茎、叶中的含量存在明显差异,大黄酚-8- O - 葡萄糖苷、没食子酸及番泻苷B在根及根茎的含量要显著大于其在叶中的含量,大黄素甲醚在根茎与叶中的含量显著低于其在根中的含量。说明一年生的大黄次级代谢产物积累丰富,其次级代谢活动活跃,所采集材料可用于次级代谢途径关键基因分析。
3.2 测序数据质控
利用Illumina HiSeq TM2000 测序平台,共得到28.04 Gb的clean read pairs并且把所有数据都上传到NCBI SRA数据库,得到登录号SRP10855670。测序数据显示,所有数据中的GC含量为47.98%,Q20、Q30值分别为97.26%、92.59%。Trinity无参组装获得140 224个unigenes,平均长度1429 nt,最长达到15 389 nt,最短序列为201 nt,N50为2045 nt。Unigenes长度分布显示,42 178条unigenes长度超过1000 nt,33 679条序列大于2000 nt。根据统计结果可以发现测序结果真实可靠,可以用于后续的分析。
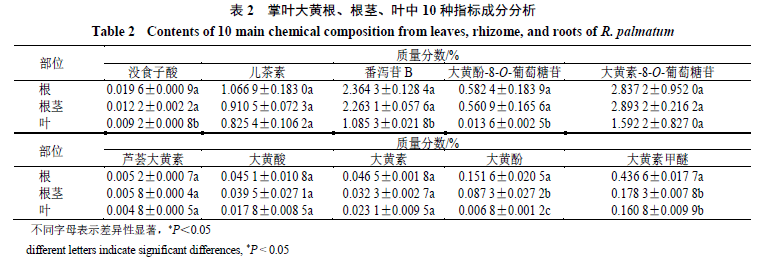
3.3 Unigene功能注释
将拼接得到的unigene与7大数据库进行比对,注释结果如表3所示,其中Nr数据库注释成功的unigene条数为95 643占总unigene数的68.2%;Nt 数据库注释成功的unigene条数为62 133占总unigene数的44.3%;KO库注释成功的unigene条数为39 641,占总unigene数的28.26%;SwissProt库注释成功的unigene条数占unigene数的52.98%;PFAM库注释成功的unigene条数为70 460,占总unigene数的50.24%;GO库注释成功的unigene条数为71 152,占总unigene数的50.74%,KOG库注释成功的unigene条为28 603占总unigene数的20.39%;在7个数据库中至少有一个数据库注释成功的unigene条数及占总unigene数的73.18%。在所有以上7个数据库中都同时注释成功的unigene条数占总unigene数的11.18%。
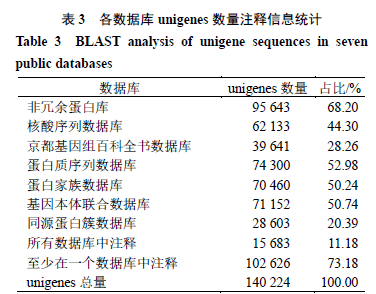
3.4基因表达水平分析
一般用FPKM值检测基因表达水平,FPKM的优势在于把测序深度和基因长度对reads计数的影响都考虑进去。通过各样品基因的FPKM箱形图及密度分布图,可以看出不同样品间基因总体表达量在分布度和离散度上表现出一定差异,如图1所示,说明掌叶大黄的根、根茎、叶的基因表达是有所差异的。
3.5 差异表达基因的筛选
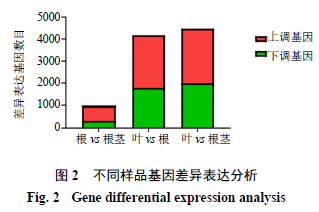
根据DEG的筛选标准|log 2 (Fold Change)| >1且q-value<0.005,发现掌叶大黄的根与叶相比,差异表达基因总数为4175个,其中2388个基因表达上调,1787个基因表达下调;根与根茎相比,差异表达基因总数为992个,其中665个基因表达上调,327个基因表达下调;叶与根茎相比,差异表达基因总数为4469个,其中2479个基因表达上调,1990个基因表达下调(图2)。
3.6 差异基因GO功能富集分析
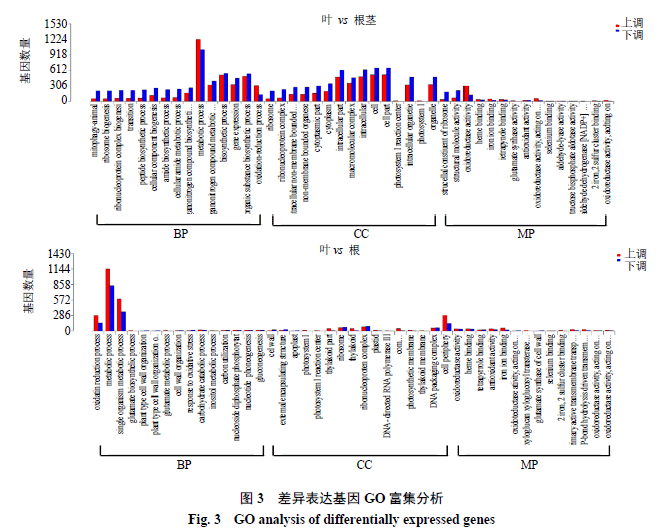
对掌叶大黄叶、根、根茎两两比对筛选出的DEG进行GO功能富集分析,从生物过程(biological process,BD)和细胞组成(cellular component,CC)、分子功能(molecular function,MF)3个方面来描述差异基因的生物学功能。由于大黄的药用部位是根与根茎,所以本实验只将叶与根及叶与根茎的对比。其中,叶比根、叶比根茎中分别有3142、3425个差异基因被注释。在生物过程中,差异基因都显著富集于代谢过程(GO:0008152)和生物合成过程(GO:0009058),叶和根间的差异基因还显著富集于单有机体代谢过程(GO:0044710);差异基因在细胞组成中,都显著富集于细胞(GO:0005623)、细胞组分(GO:0044464);分子功能中,差异基因主要都参与氧还原酶活性(GO:0016491)、结构分子活性(GO:0005198)、核糖体的结构成分(GO:0003735)、四吡咯结合(GO:0046906)、血红素结合(GO:0020037)等(图3)。
3.7KEGG富集分析差异表达基因
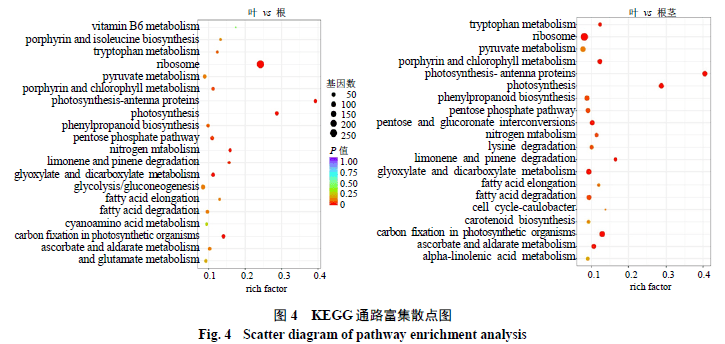
KEGG富集结果显示,在叶比根中,差异基因被注释到109条通路中,包括植物信号转导(ko04075)、苯丙烷生物合成(ko00940)、淀粉和蔗糖代谢(ko00500)、苯丙氨酸代谢(ko00360)、萜类骨架生物合成(ko00900)等;叶比根茎中,差异基因获得了112条通路的注释,包括类胡萝卜素生物合成(ko00906)、缬氨酸、亮氨酸和异亮氨酸生物合成(ko00290)、磷酸肌醇代谢(ko00562)、脂肪酸生物合成(ko00061)、柠檬烯和蒎烯的降解(ko00903)等,其中苯丙烷生物生物合成通路被显著富集,33个差异基因被注释到该通路中。差异基因中显著性富集的Pathway可能是蒽醌类化合物生物合成的主要生化代谢途径(图4)。
3.8 与蒽醌合成相关的关键差异表达基因筛选
参与大黄蒽醌类化合物骨架生物合成MVA、MEP、莽草酸及聚酮途径的差异表达基因见表4。MVA途径中的关键酶有AACT、HMGS、HMG-CoA HMGR及MPD。其中AACT和MPD在根中的表达量显著高于其在叶及根茎中的表达量,HMGS、HMGR在叶中的表达量显著高于其在根及根茎中的表达量。
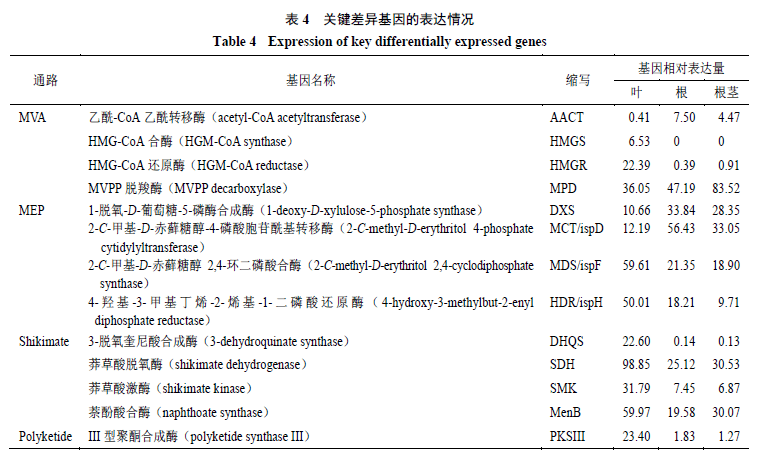
MEP途径中,关键酶的差异基因有DXS、MCT/ispD、CMK/ispE和HDR/ispH。其中DXS和MCT/ispD在根中的表达量要显著高于其在叶及根茎中的表达量,MCT/ispD、HDR/ispH在叶中的表达量要显著高于其在根及根茎中的表达量。
莽草酸途径中,差异表达基因编码的酶有DHQS、SDH、SMK及MenB。这4个基因在叶中的表达量都显著高于其在根及根茎中表达量。 聚酮途径中只检测到一个差异表达基因即PKSIII,这个基因在叶中的表达量显著高于其在根及根茎中的表达量。
3.9 荧光定量检测分析
随机选取12个与蒽醌合成相关的基因作为检测对象,以掌叶大黄的actin基因作为内参基因,进行qRT-PCR检测。结果表明11个差异表达基因的qRT-PCR测定结果与转录组测序分析结果一致,BHLH4的测定结果与转录组测序分析结果不一致(图5),可能是由于实验时使用了新提取的RNA样品,才导致使少数基因的表达趋势与差异表达分析中的FPKM值出现了差异。总体而言,本研究中的转录组分析数据得到的差异表达基因的信息是可信的。

4 讨论
蒽醌类物质在生物体内的合成过程十分复杂,整个过程涉及多条代谢途径产生的多种代谢产物。目前蒽醌类成分的生物合成途径尚未被完全阐明,但普遍认为植物中蒽醌类物质生物合成主要源于2条代谢途径:莽草酸/邻琥珀酰苯甲酸途径(shikimate/osuccinylbenzoic acid route)和聚酮途径(polyketide pathway)[17-18]。本研究对一年生掌叶大黄的根、根茎、叶进行转录组测序,筛选差异表达基因,并结合GO、KEGG富集分析,有助于在转录组水平上构建蒽醌类物质生物合成网络,筛选参与蒽醌类物质生物合成关键基因。
莽草酸/邻琥珀酰苯甲酸途径合成蒽醌母核的前体来自于多种代谢途径,该合成途径主要涉及莽草酸途径、TCA循环、MVA途径和MEP途径。研究发现MVK、HMG-CoA还原酶是MVA通路中的 关键酶。有研究发现,在植物体内过表达MVK可以提高异戊二烯类物质的含量[19]。用抑制剂抑制HMG-CoA还原酶活性后,番茄的生长速度会受到明显影响,当加入MVA后,番茄又恢复生长,进一步说明HMG-CoA在MVA途径中起到重要作用[20]。本研究中,观察到了HMG-CoA还原酶编码基因的差异表达现象,但并没有筛选到MVK基因的差异表达,这可能与植物的生长状态有关。
有研究者认为,可以通过调控MEP途径影响蒽醌的生物合成[21]。在拟南芥中,使DXS基因过表达,发现植物中多种类异戊二烯终产物(包括叶绿素、类胡萝卜素、生育酚和ABA)的含量均升高,说明DXS是MEP途径中关键的限速酶[22]。在Morinda citrifolia细胞系过表达DXS基因,与对照细胞系相比,过表达DXS基因的细胞系蒽醌产量提高了约24%,说明DXS对蒽醌的生物合成具有十分显著的影响[23]。在掌叶大黄的转录组中,我们发现了差异表达的DXS基因,其在根中的表达量要显著高于在叶与根茎中的表达量,这可能与蒽醌类化合物积累于掌叶大黄的根部有关系。
聚酮途径是由PKS参与反应。PKS分为3大类:PKS I、PKS II和PKS III[24]。其中,PKS I、PKS II多存在于真菌与细菌中,PKSIII不仅在细菌、真菌中广泛分布,而且在植物体内也大量存在。PKS III在生物体内主要参与具有生物活性的聚酮类次级代谢产物的合成,例如黄酮类物质、二苯乙烯类物质的生物合成[25-27]。在本研究中筛选得到差异表达的PKS III基因,其在叶中的表达量要显著高于其在根与根茎中的表达量,与测得的蒽醌类化合物的在根、茎与根茎中积累量没有显著相关性,这可能与聚酮途径的复杂性有关,说明PKS III单个基因的表达量并不能影响最终产物的累积量。
本研究利用Illumina二代高通量测序平台开展了掌叶大黄根、根茎及叶的转录组分析来研究掌叶大黄3个部位差异表达基因,成功筛选出差异表达的编码MVA、MEP、莽草酸及聚酮途径的多个关键酶差异表达基因,这些差异基因与蒽醌的生物合成有重要关系,为后蒽醌类物质生物合成过程中关键酶及其基因的分离、克隆和表达特征的研究及明确蒽醌类物质生物合成途径中调控因子奠定物质基础。
利益冲突所有作者均声明不存在利益冲突
参考文献(略)
来 源:邹建珍,胡晓晨,李依民,郝紫彤,张 岗,刘蒙蒙.掌叶大黄转录组测序及蒽醌类合成关键酶基因差异表达分析 [J]. 中草药, 2023, 54(7):2217-2225.
- 本文固定链接: https://www.maimengkong.com/zixun/1513.html
- 转载请注明: : 萌小白 2023年5月3日 于 卖萌控的博客 发表
- 百度已收录
