
糖尿病是一种以血糖升高和代谢紊乱为主要特征的疾病,属中医学“消渴病”范畴。其中2型糖尿病占所有糖尿病患者的95%左右,严重威胁人类健康[1]。2型糖尿病又称为非胰岛素依赖型糖尿病,多发于肥胖及中老年人群,患者体内胰岛素分泌相对不足或作用效果不佳。2型糖尿病可诱发多种并发症,包括糖尿病心血管疾病、糖尿病肝病、糖尿病肾病等。临床上治疗2型糖尿病一般分为注射胰岛素和口服降糖药2种方案。然而,这2种方案的持续治疗通常会导致耐药性和明显的不良反应,甚至可引起多种心脏毒性、神经毒性等损害患者身体健康[2-3]。中药及其有效成分在2型糖尿病的防治中具有疗效稳定、不良反应少、可长期使用、通过多靶标多途径调节代谢紊乱,起到保护胰腺结构和功能的作用。因此,一些具有降血糖活性的中药越来越受到人们的关注[4]。
金线莲Anoectochilus roxburghii(Wall.) Lindl. 是兰科开唇兰属多年生草本药用植物,营养成分丰富,在民间有“鸟人参”“药之王”“神草”“金草”等美誉,是我国名贵的天然药物[5]。近年来,金线莲逐渐成为研究热点[6]。研究表明,金线莲具有多种生物活性,包括抗肿瘤[7-8]、保肝[9]、降血糖[10]、抗氧化[11]和免疫调节作用。目前,关于金线莲用于治疗2型糖尿病的具体作用机制尚未明确。网络药理学是通过将多元药理学网络映射到人类疾病-基因网络上而建立起来的。该方法将揭示与疾病相关的一些重要药物靶标。本研究首先通过文献检索的方式查找出金线莲的化学成分信息,利用网络药理学构建有效成分-疾病-靶标网络图,并进行生物学功能分析,初步预测金线莲干预2型糖尿病可能的信号通路和关键作用靶点。同时结合动物实验,对网络药理学筛选出的关键作用靶标进行初步验证,采用造模后给药治疗的方式,检测预测的相关蛋白水平,评价金线莲对2型糖尿病的干预效果,为金线莲的临床应用提供实验依据。
1 材料与方法
1.1 网络药理学分析
1.1.1化学成分数据库构建及靶标预测本研究首先从PubChem和PubMed等数据库中搜集金线莲所含有的化学成分,建立金线莲化学成分数据库,使用ChemDraw18.0绘制化合物结构,获取每个化学成分的SMILES构型,并对化学成分进行分类。通过Swiss Target Prediction数据库和Similarity Ensemble Approach数据库检索每个化学成分的作用靶标。利用UniProt数据库对化学成分的作用靶标的名称进行标准化处理。
1.1.22 型糖尿病作用靶标的查询GeneCards数据库是人类基因数据库,DisGeNET数据库是综合性的基因-疾病关联关系数据库。以“type 2 diabetes mellitus”为关键词在GeneCards和DisGENET数据库查找2型糖尿病相关的作用靶标,并删除重复的靶标。为了获得与2型糖尿病更加相关的靶标,将根据得分进行中位值的筛选并且采用UniProt数据库对靶标进行规范化处理。
1.1.3蛋白相互作用(protein-protein interaction,PPI)网络的构建利用Venny 2.1获取金线莲化学成分与2型糖尿病的共有靶标,并将其导入STRING数据库和Cytoscape 3.8.0,构建可视化的PPI网络图。并将物种设定为“Homo sapiens”,可信度>0.9。
1.1.4拓扑分析与MCODE聚类分析采用Cytoscape 3.8.0软件构建“成分-靶标-通路-疾病”网络图,利用插件Network Analyzer进行拓扑分析,计算节点自由度、接近中心性等。通过度(degree)排序,选取分值大于2倍平均分的基因作为关键靶标,获得金线莲治疗2型糖尿病的关键靶标及关键通路。通过插件MCODE进行基因簇的分析以及核心靶标的筛选。
1.1.5基因本体(gene ontology,GO)富集分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集为了阐明金线莲在2型糖尿病治疗中的作用机制,将金线莲与2型糖尿病的共有基因导入DAVID 6.8数据库,限定物种为“Homo Sapiens”,设定阈值P<0.05,进行KEGG通路富集分析和GO生物过程富集分析。
1.2 实验验证
1.2.2药材金线莲由金华匠康金草生态农业科技有限公司提供,经浙江工业大学药学院王平教授鉴定为兰科植物金线莲A. roxburghii (Wall.) Lindl. 干燥全草。
1.2.4仪器集热式恒温加热磁力搅拌器(上海力辰邦西仪器科技有限公司);超声波清洗机(昆山式超声仪器有限公司);旋转蒸发仪(上海亚荣生化仪器厂);GA-3型血糖仪(三诺生物传感股份有限公司);全自动生化分析仪LWC400(深圳蓝韵医疗器械);球磨仪(上海净信科技有限公司)。
1.2.52 型糖尿病模型的构建高糖、高脂饲料饲养大鼠8周后,禁食12 h,除对照组外,其他各组大鼠ip 0.1 mmol/L柠檬酸盐缓冲液(pH 4.5)配制的40 mg/kg链脲佐菌素,同时,对照组大鼠ip同等剂量0.1 mmol/L柠檬酸缓冲液(pH 4.5)[11-13]。1周后禁食12 h,检测空腹血糖(fasting blood sugar,FBG),若FBG连续2次≥11.1 mmol/L,同时伴有多饮、多食、多尿症状的大鼠,即视为造模成功。
1.2.6 溶液的配制
(1)金线莲提取液的配制:取金线莲干粉末(过60目筛)50 g,液料比为20∶1,提取溶剂为蒸馏水,于水浴100 ℃的条件下回流提取1 h,减压抽滤并收集滤液[14],重复以上步骤再提取1次,2次的滤液合并后于70 ℃的条件下减压旋转蒸发至222 mL,即为金线莲高浓度提取液;提取液中、低浓度分别为高浓度提取液的1/2和1/4。金线莲提取液直接ig给药。通过HPLC-UV测定,金线莲高浓度水提液中金线莲苷、水仙苷、芦丁、阿魏酸及山柰素质量分数分别为13.49%、0.30%、0.10%、0.04%和0.02%。
(2)阳性药物的配制:将去除包衣的盐酸二甲双胍片投入球磨仪研磨成粉末,0.70 g盐酸二甲双胍粉末溶于80 mL蒸馏水中,振荡摇匀,制成盐酸二甲双胍混悬液,储存于4 ℃冰箱备用。
1.2.7 分组与给药健康雄性SD大鼠使用普通饲料适应性饲养1周后,分6个组,每组6只,分别为对照组、模型组、二甲双胍(阳性对照,70 mg/kg)组及金线莲高、中、低剂量组。金线莲给药剂量按照人临床使用剂量0.071 4 g/kg换算为大鼠用量0.45 g/kg,此剂量为金线莲低剂量组给药量,金线莲中、高剂量组给药剂量分别为0.9、1.8 g/kg。造模成功后按照8 mL/kg的给药体积连续ig 3周,对照组和模型组给予等量的生理盐水,并于第7、14和21天称体质量和测定FBG。在整个实验周期内,每天观察大鼠的基本状况。
1.2.8靶标的验证金线莲干预3周后各组大鼠禁食不禁水过夜,ig 10%戊巴比妥钠(3.5 mL/kg)进行麻醉[15]。钝性分离腹主动脉后,用含肝素钠抗凝剂的采血管采集血液,3000 r/min离心10 min,分离得到血清。按照相应ELISA试剂盒要求,检测血清中各靶标的水平。
1.2.9 胰岛素水平的测定金线莲干预3周后,取大鼠血清适量采用酶联免疫法检测胰岛素水平。
1.2.10病理学检查取胰腺组织用4%多聚甲醛溶液固定,石蜡包埋、切片,采用常规苏木精-伊红染色,在光学显微镜观察并拍照分析。
1.2.11统计学分析应用SPSS 20.0统计学分析软件进行数据处理,数据均以表示。组间比较满足方差齐性时采用单因素方差分析,不满足方差齐性时采用非参数检验,P<0.05代表具有统计学差异。
2 结果
2.1 网络药理学分析
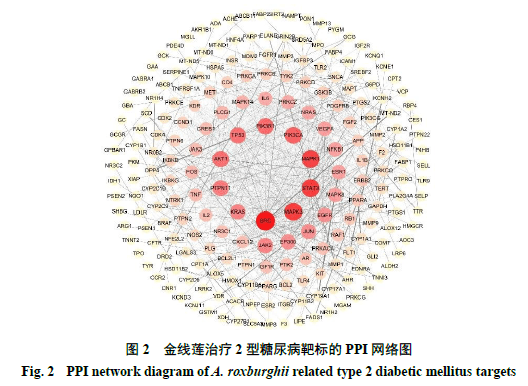
2.1.1PPI 网络的构建与分析通过文献数据库收集整理共获得金线莲80种化学成分,其中黄酮类25个,有机酸和挥发性化合物25个,三萜类10个,生物碱和核苷类7个,甾体类7个,糖苷类化合物6个。通过Swiss Target Prediction数据库和Similarity ensemble approach数据库筛选获得金线莲化学成分860个靶标。利用GeneCards和DisGENET数据库筛选获得1323个2型糖尿病相关的基因。利用Venny 2.1得到249个共有靶标,见图1。将得到的249个共同靶标导入STRING平台构建PPI网络图,将生物种类设定为“Homo sapiens”,选取最低相互作用阈值大于0.9的靶标,得到PPI网络图,见图2。该网络图中共有249个节点和989条边,平均度值为7.94。

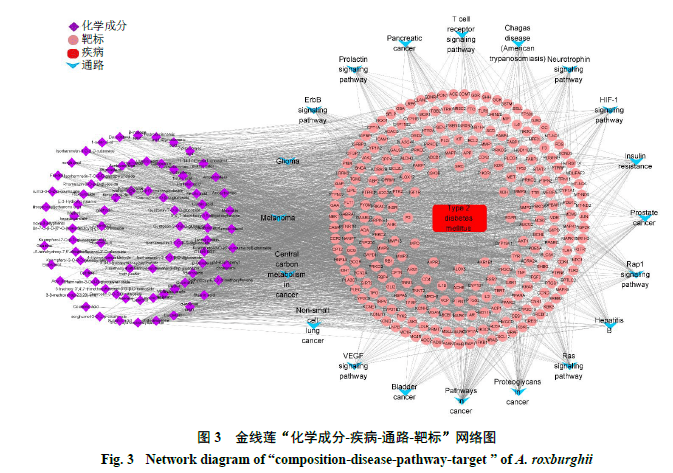
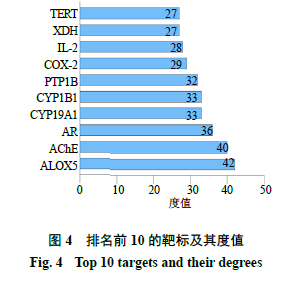
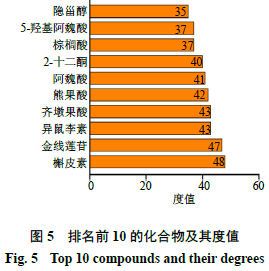
2.1.2“化学成分-疾病-通路-靶标”网络图的构建利用Cytoscape 3.8.0软件绘制“化学成分-疾病-通路-靶标”网络图。如图3所示,紫色为化学成分,粉色为2型糖尿病靶标,蓝色为最显著的前20条通路,红色为疾病即2型糖尿病。通过Network Analyzer工具进行拓扑分析,通过度值排序,选取分值大于2倍平均分的基因作为关键靶标,总共筛选出32个关键靶标,前10个靶标如图4所示。金线莲对2型糖尿病治疗作用主要与花生四烯酸-5-脂加氧酶(arachidonic acid-5-lipoxygenase,ALOX5)、乙酰胆碱酯酶(acetylcholinesterase,AChE)、醛糖还原酶(aldose reductase,AR)、细胞色素P45019A1(cytochrome P45019A1,CYP19A1)、细胞色素P4501B1(cytochrome P4501B1,CYP1B1)、蛋白酪氨酸磷酸酶-1B(protein tyrosine phosphatase 1B,PTP1B)、环氧化酶-2(cyclooxygenenase-2,COX-2)、白细胞介素-2(interleukin-2,IL-2)等作用靶标有关。对其进行网络拓扑分析,节点度值排名前5的化合物如图5所示,分别为槲皮素、异鼠李素、金线莲苷、齐墩果酸和熊果酸,节点度较高的化合物是金线莲发挥2型糖尿病治疗作用的关键成分。
2.1.3GO 功能富集分析与KEGG通路富集分析将249个交集靶标导入DAVID 6.8数据库,进行GO富集分析,筛选P<0.05的条目,总共富集到349条生物过程相关、86条细胞组成相关和165条分子功能相关的条目。如图6所示,生物学过程相关的条目主要包括RNA聚合酶Ⅱ启动子转录的正调控、凋亡的负调控、蛋白质磷酸化、对药物的反应、基因表达的正调控等。细胞组成相关的条目涉及细胞质膜、细胞质溶胶、胞外外泌体、细胞膜、细胞外间隙等。分子功能相关的条目主要集中于相同蛋白质结合、蛋白质同源二聚化活性、酶结合、蛋白质激酶活性、血红素结合、蛋白酪氨酸激酶活性等方面。
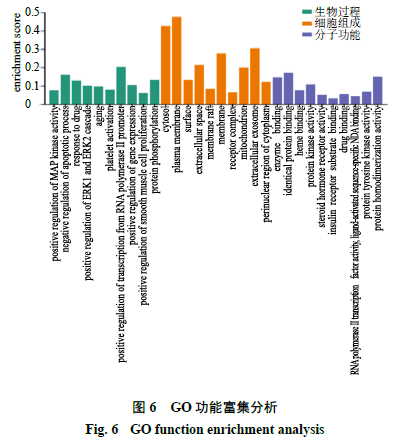
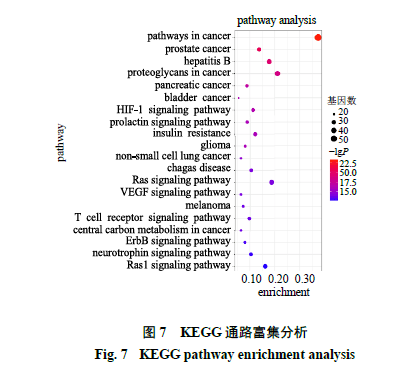
KEGG通路富集分析结果如图7所示,具有显著意义(P<0.05)的通路共139条,主要与Ras信号通路、胰岛素抵抗信号通路、低氧诱导因子(hypoxia-inducible factor,HIF-1)信号通路、催乳素信号通路、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路和T细胞受体信号通路等方面有关。
2.2 实验验证
2.2.1一般状态观察糖尿病的典型症状包括多饮、多食和消瘦。造模后,与对照组相比,其他组大鼠饮水量和进食量明显增加,懒动。给药期间,金线莲各剂量组饮水量较模型组减少,但比对照组增多;进食量较模型组减少,但与对照组相比增多;精神状态较模型组大有好转。各组间体质量差异无统计学意义(P>0.05)。
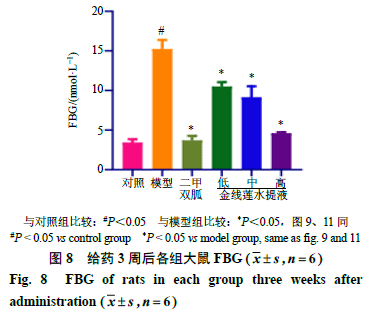
2.2.2降血糖作用血糖是衡量金线莲对2型糖尿病大鼠治疗作用的基础指标。各组大鼠ig 3周后,利用血糖仪测定每只大鼠的FBG值。如图8所示,模型组大鼠FBG平均值达到15.0 mmol/L,表明造模成功;与模型组大鼠相比,二甲双胍组与金线莲各剂量组大鼠FBG值均显著下降(P<0.05)。
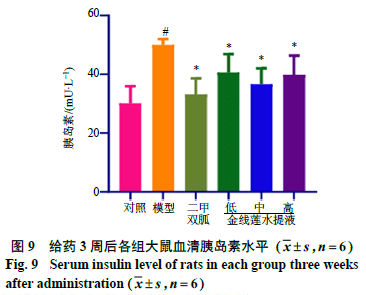
2.2.3胰岛素水平如图9所示,ig 3周后,与对照组相比,模型组大鼠血清胰岛素水平显著性升高(P<0.05);与模型组相比,二甲双胍组与金线莲各剂量组大鼠胰岛素水平均显著下降(P<0.05)。
2.2.4胰腺组织病理学变化如图10所示,与对照组比较,模型组大鼠的胰腺细胞排列紊乱,腺泡分布松散,胰岛细胞坏死明显。然而在二甲双胍组和金线莲各剂量组治疗3周后,胞浆均匀无空泡,胰岛结构变得更为清晰且边界清楚,细胞核较清晰,但胰岛细胞轻微坏死,程度较对照组严重。

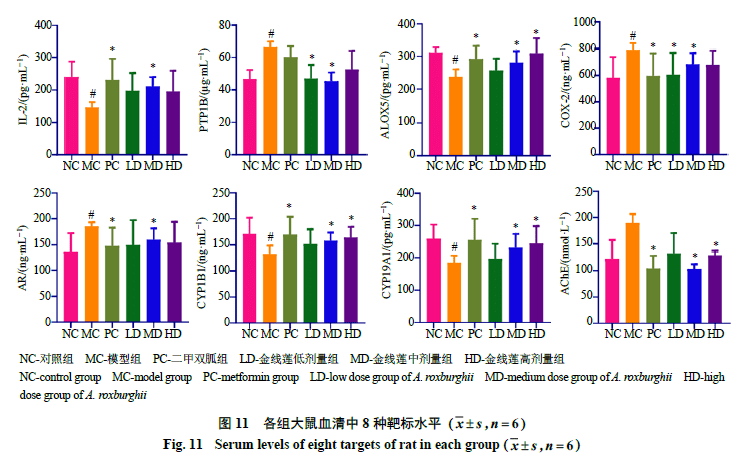
2.2.5靶标的验证根据网络药理学的预测结果,金线莲对2型糖尿病的治疗作用与ALOX5、AChE、AR、CYP19A1、CYP1B1、PTP1B、COX-2及IL-2等靶标有关。为了验证该预测结果,采用酶联免疫法检测大鼠血清中8种预测靶标水平,结果如图11所示。与对照组比较,模型组大鼠血清中IL-2、ALOX5、CYP1B1和CYP19A1水平均显著降低(P<0.05),而COX-2、PTP1B和AR水平显著升高(P<0.05)。与模型组比较,二甲双胍组大鼠血清中IL-2、ALOX5、CYP1B1和CYP19A1水平均显著升高(P<0.05),AChE、COX-2和AR水平显著降低(P<0.05)。金线莲低剂量组大鼠血清COX-2和PTP1B水平显著降低(P<0.05);中剂量组大鼠血清IL-2、ALOX5、CYP1B1和CYP19A1水平显著升高(P<0.05),COX-2、PTP1B、AChE和AR水平显著降低(P<0.05);高剂量组ALOX5、CYP1B1和CYP19A1水平显著升高(P<0.05),AChE水平显著降低(P<0.05)。
3 讨论
2型糖尿病是一种以高血糖和胰岛素抵抗为主要特征的复杂代谢紊乱疾病,对肾脏和肝脏等器官系统都有影响,严重威胁人类健康与寿命[16]。目前,2型糖尿病多发、高发且越来越年轻化,及早干预是降低并发症和致死率的关键。中药在2型糖尿病的治疗方面有着显著的疗效和优势,亟待守正创新和传承发展。
网络药理学技术在药物与疾病之间的关系研究以及疾病靶标和途径的预测方面应用越来越多。在药物设计和开发中,网络药理学不仅可以多维度地阐明药物的作用机制、预测新的药理作用的同时也可以降低药物发现的成本[17-18]。通过网络药理学的预测发现,金线莲治疗2型糖尿病的关键活性成分为金线莲苷、槲皮素、异鼠李素、齐墩果酸、熊果酸等。槲皮素具有促进胰腺干细胞再生和胰岛细胞分化的作用,通过其抗氧化、抗炎和抗凋亡活性来保护胰腺细胞免受损伤,并调节与葡萄糖代谢相关的酶活性来降低血糖,增加对胰岛素的敏感性[19-20]。异鼠李素的自由基清除活性,主要通过3种主要的抗氧化途径实现:氢原子转移、单电子转移随后质子转移和顺序质子丢失电子转移[21]。金线莲苷具有调节酶促抗氧化剂的活性、清除自由基和降低NO的含量,减少对胰岛β细胞的刺激且改善其功能[22]。金线莲苷通过调节基质金属蛋白酶(matrix metalloproteinase,MMP)-组织抑制剂金属蛋白酶(tissue inhibitor metalloproteinase,TIMP)的平衡来维持血管结构的动态平衡,恢复血管内皮细胞结构,有利于生物活性物质的正常分泌[23]。熊果酸的化学结构为α-香树脂醇型五环三萜类,可以将血糖酵解为其他糖代谢产物并且减少葡萄糖的吸收,可能的作用途径为促进葡萄糖激酶mRNA表达、提高糖代谢关键酶葡萄糖激酶的含量和抑制α-葡萄糖苷酶活性等;保护胰腺β细胞并刺激胰岛分泌胰岛素;抑制蛋白酪氨酸磷酸酶1β和激动胰岛素受体TGR5,加快体内葡萄糖的摄取和利用速率[24-25]。齐墩果酸可以降低细胞内α-葡萄糖苷酶和α-胰腺淀粉酶的活性来调节外源葡萄糖的吸收,同时抑制糖原分解限速酶-糖原磷酸化酶的活性,减少内源性葡萄糖的生成和糖原的分解。除此之外,齐墩果酸还可以通过TGR5途径刺激胰岛β细胞释放胰岛素,从而起到改善胰岛素抵抗的作用[26-27]。另有研究显示,金线莲多糖也具有降血糖作用[28]。
高血糖可促使细胞膜糖基化,破坏粒细胞结构,限制其免疫功能,吞噬杀菌力减低,延缓淋巴细胞的分裂,导致辅助性T细胞的减少。IL-2主要是由辅助性T细胞产生,高血糖导致IL-2分泌减少[29]。金线莲各剂量组的血糖水平显著下降,IL-2水平也回归正常。PTP1B对胰岛素传导过程具有负调节作用。当发生胰岛素抵抗时,PTP1B的表达水平显著增强,促使胰岛素受体及受体底物酪氨酸磷酸化,阻断胰岛素的降血糖作用[30]。金线莲给药后PTP1B水平恢复正常水平。ALOX5是花生四烯酸代谢途径中的关键酶之一。研究表明,花生四烯酸具有降低糖尿病大鼠血糖、提高机体抗氧化能力的功效[31]。模型组大鼠ALOX5水平降低,花生四烯酸的分解代谢受到抑制,表明模型组大鼠体内花生四烯酸的代偿性积累。金线莲给药后ALOX5水平恢复正常。COX-2作为炎症反应的关键酶,过度表达能降低机体对胰岛素的敏感性,减少胰岛细胞对葡萄糖的利用[32]。金线莲给药后能显著降低血清COX-2水平。AR是体内多元醇代谢途径的主要酶,可以催化葡萄糖产生大量的山梨醇。由于山梨醇不易透过细胞膜,山梨醇在细胞间质大量堆积,这将对机体健康造成严重问题,如糖尿病和肾脏损伤等[33]。因此,抑制AR的活性可以减少山梨醇的产生,降低患糖尿病的风险。模型组的AR水平显著升高,而金线莲给药后AR水平回归正常。
2型糖尿病与氧化应激机制有着密不可分的关系。CYP1B1具有抑制内皮细胞氧化应激反应的作用。抑制CYP1B1的活性能降低氧化应激水平和阻碍c-Jun氨基末端激酶(c-Jun N -terminal kinase ,JNK)信号转导,而JNK信号通路在氧化应激中是至关重要的[34]。模型组CYP1B1水平下降,而金线莲给药后CYP1B1水平恢复正常水平。糖代谢与CYP450酶家族基因的多态性密切相关。CYP19A1基因与性激素、雌激素以及芳香化酶的活性有关,其可能通过影响雌激素水平起到降血糖的作用[35]。模型组CYP19A1水平下降,而金线莲给药后恢复正常。
AChE具有诱导血管内皮细胞依赖性舒张的作用,然而AChE的过度表达可使血管内皮细胞受损。许多动物实验证实胰岛素抵抗与内皮细胞功能紊乱相关,当内皮细胞功能发生紊乱时,机体内游离脂肪酸水平升高,胰岛素信号转导通路受阻,胰岛素无法及时对葡萄糖分解利用。模型组AChE 水平升高,而金线莲给药后AChE 水平恢复正常。
综上所述,金线莲可以通过减少炎症信号通路关键酶的表达、改善胰岛素抵抗从而发挥降血糖的作用,可用于开发抗糖尿病新药。本研究体现了金线莲多成分、多通路、多靶标的作用特征,对明确金线莲治疗2型糖尿病的作用机制具有重要意义。
利益冲突所有作者均声明不存在利益冲突
参考文献(略)
- 本文固定链接: https://www.maimengkong.com/moreshare/1644.html
- 转载请注明: : 萌小白 2023年12月15日 于 卖萌控的博客 发表
- 百度已收录
