肝细胞癌(HCC)是一种高死亡率的原发性肝癌。而在我国,HCC是最常见的恶性肿瘤之一,难发现又易转移、易复发,患者五年内生存率低。HCC常见的转移位置包括肺和骨骼,转移到骨骼的HCC会干扰成骨和碎骨过程的平衡,造成溶骨性病变:HCC转移到骨骼后,旁分泌多种细胞因子,诱导破骨细胞前体细胞分化,最终形成成熟破骨细胞。而在溶骨的过程中,伴随着多种生长因子和钙离子的释放,又促进了癌细胞的扩张和增殖。
传统治疗骨转移HCC的方案采用溶骨因子或碎骨细胞干扰剂来实现,但易引发患者并发症或病情恶化,因此,研究HCC骨转移的机制成了开发新治疗方案的关键点。今天,小编就带大家来看看我们康测协助客户在这一问题上所做的探索(Hepatology IF=14.7)。

高骨转移潜力HCC细胞的筛选
为获得具有更高骨转移潜力的HCC细胞,作者给小鼠心内注射HCC细胞,使之进入循环系统,再从小鼠骨骼中分离并筛选培养所需的骨转移HCC细胞(下图A),将之命名为BM4-1,BM4-2和BM4-3。

作者将这三类细胞再注射入小鼠,通过影像学与解剖验证,这三类细胞确实具有极强的骨转移能力(见下图)。
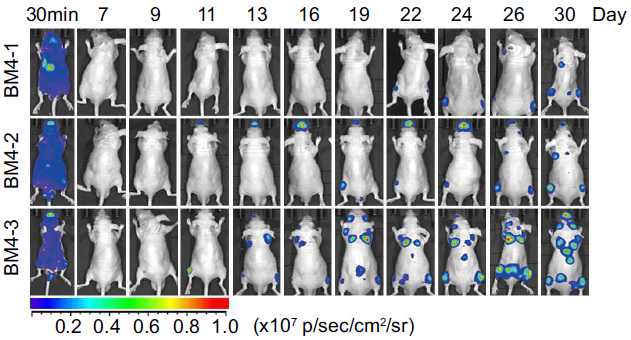
而X光以及组织染色的结果则可以明显观察到溶骨现象和破骨细胞的过度激活(见下图)。
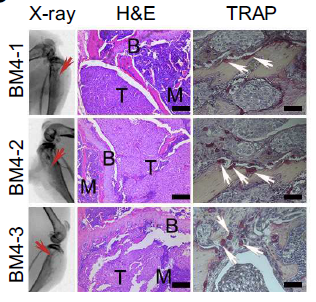
上述实验证明筛选到的BM4-1,BM4-2和BM4-3具有骨转移HCC的潜力和特性,是适宜的实验材料。
LncRNA--H19在高骨转移潜力HCC细胞中大量表达
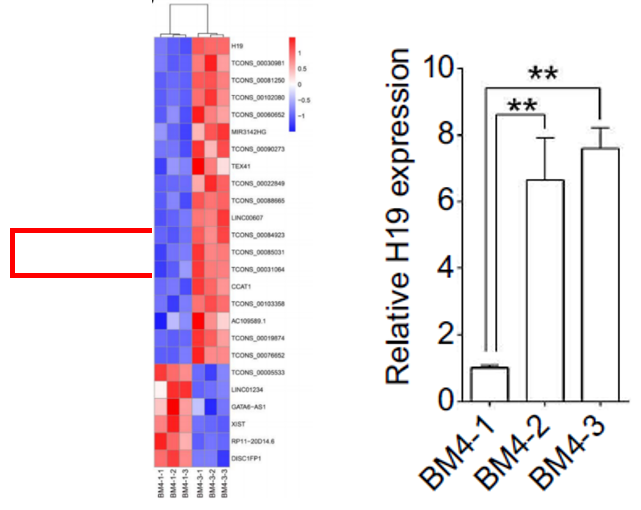
获得材料后,作者委托我司进行了转录组测序,从测序数据以及后续qPCR验证结果中发现,lncRNA--H19的转录本在BM4-2和BM4-3细胞中表达量变化最大(见下图)。
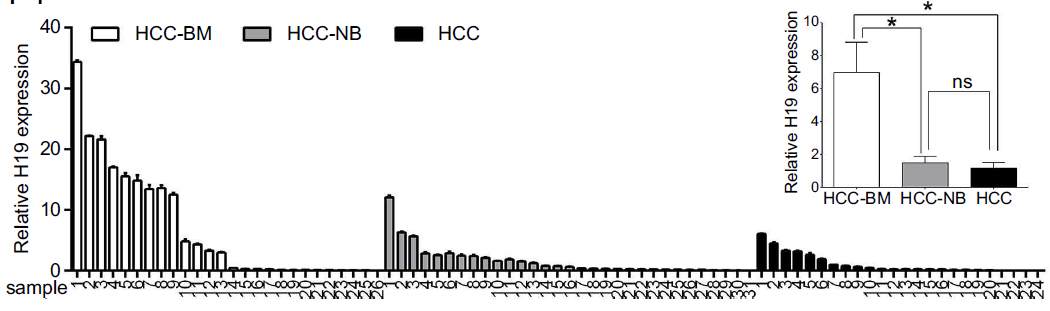
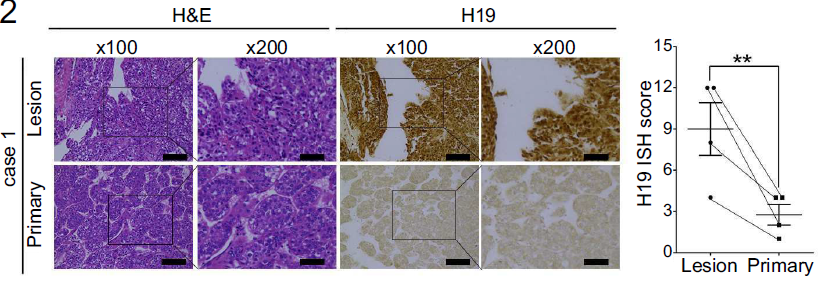
同时,临床样本的测序结果也表明(见下图),发生骨转移的HCC患者,其H19的表达量显著高于未发生骨转移的患者样本。
原发骨肿瘤和HCC骨转移患者样本的原位杂交的结果(见下图)亦表明,H19在HCC骨转移患者样本中表达量更高。
H19的表达会促进BM4细胞骨转移并恶化溶骨症状
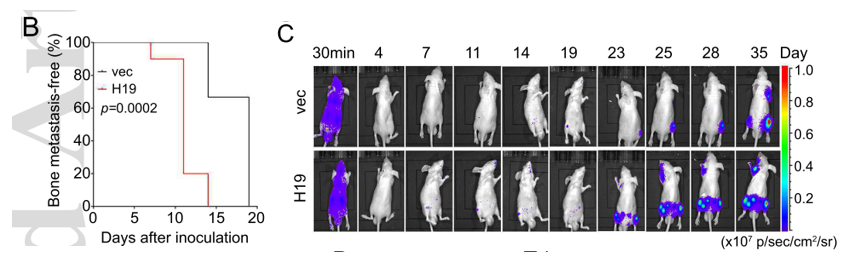
既然已发现H19在骨转移HCC细胞中表达量更高,那么高表达的H19又会对HCC的骨转移产生怎样的影响呢?为回答这一问题,作者构建了过表达H19的BM4细胞,将之注射入裸鼠(无胸腺小鼠)体内,结果表明较之于对照组,过表达H19的BM4细胞产生骨转移的时间更早,并且造成的肿瘤负荷更大(见下图B~C)。
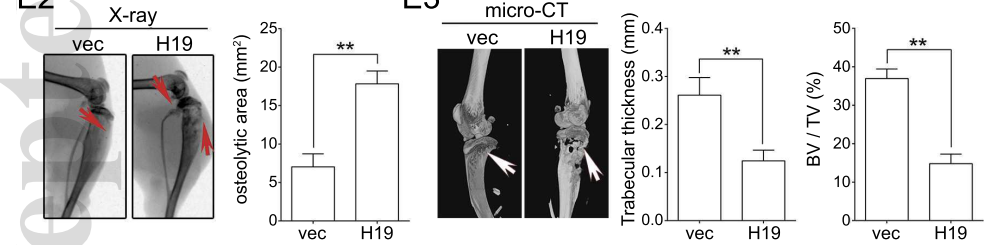
对小鼠进行解剖以及X光,CT等检测,可以明显看出被注射了过表达BM4组的小鼠溶骨症状更为严重(下图)。
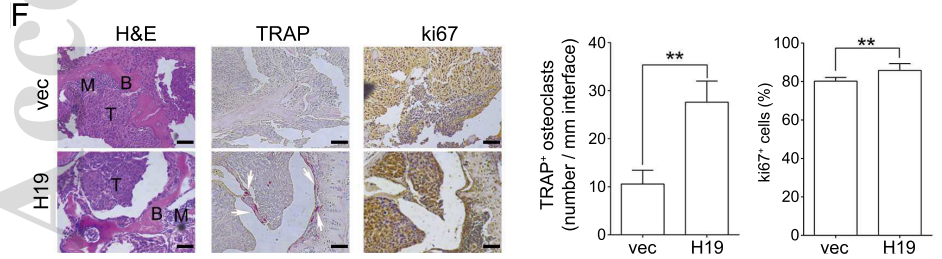
HE组织染色(下图左H&E)展示出H19过表达组出现更明显的HCC骨转移病灶;TRAP染色阳性(下图中TRAP)展示H19过表达组的破骨细胞更为活跃;ki67染色结果(下图右ki67)显示了H19过表达组中,BM4细胞的增殖更显著。综合上述实验结果,可以发现H19具有促进BM4细胞骨转移并使溶骨症状恶化的能力。
H19的表达可促进破骨细胞生成并抑制OPG的表达
在HCC的骨转移进程中,破骨细胞的生成是其中关键的一步,故作者检测了H19的表达与破骨细胞生成间是否存在关系。
在来自过表达H19的BM4细胞(BM4/H19)的条件培养基中培养小鼠巨噬细胞样细胞系RAW264.7,并进行TRAP染色发现,TRAP阳性的多核细胞明显多于来自对照组的条件培养基,而这正是破骨细胞生成的标志(下图A)。此外,使用pit assay检测破骨细胞的溶骨能力时,发现过表达H19的BM4细胞中侵蚀区域显著大于对照组,这同样也说明过表达H19促进了溶骨现象(下图B)。
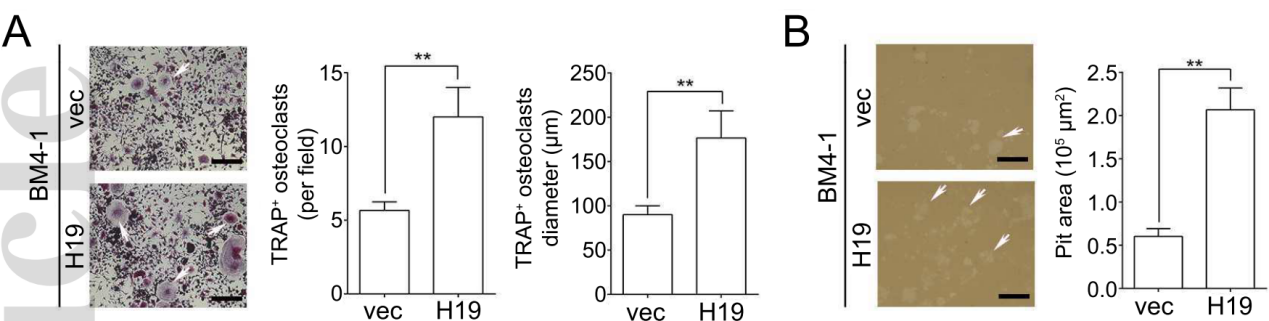
而当换成敲低H19表达的BM4细胞时,则获得了相反的结果,即破骨细胞的生成较慢且溶骨现象更缓和。

这些实验证实,H19可以促进HCC骨转移后诱导的破骨细胞生成。
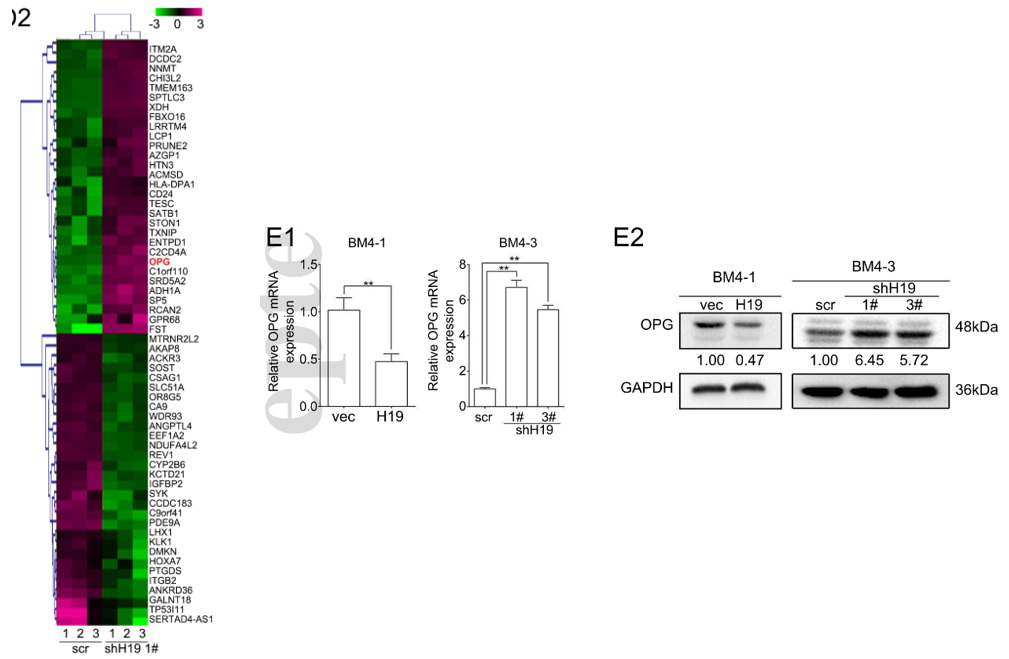
作者对敲低H19的BM4细胞进行了基因芯片分析实验,以寻找受H19调控的潜在目标基因,他们筛选到一个显著受H19负调控表达的基因:OPG(下图左)。OPG编码的诱骗受体可以与坏死因子RANKL结合,阻断其诱导的细胞凋亡,从而抑制破骨细胞生成。通过qRT-PCR和western等实验,作者分别从转录和蛋白水平验证了H19对OPG的表达起负调控作用(下图右)。
H19通过p38MAPK通路来抑制OPG的表达
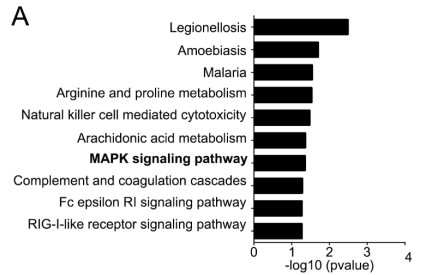
在对转录组测序以及基因芯片的数据进行KEGG分析过程中,作者发现MAPK通路受到H19表达的影响(下图),已有报道MAPK信号通路参与到骨骼发育和重建中,那么H19是否通过MAPK信号通路调控OPG的表达呢?
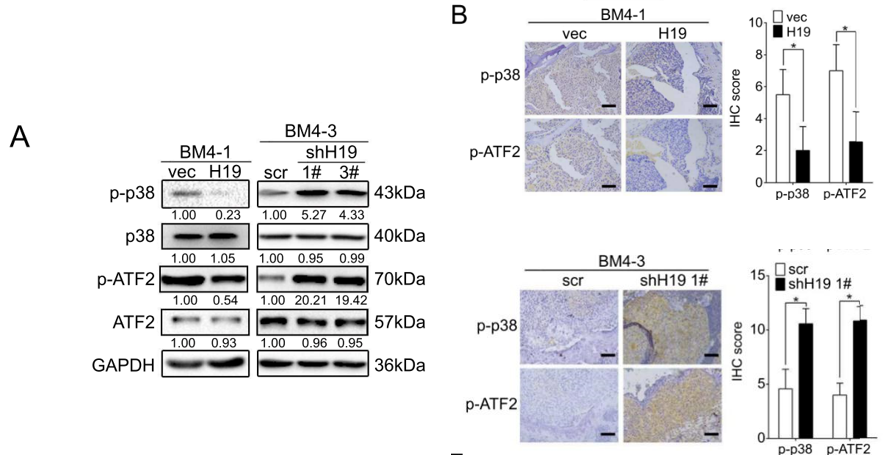
在过表达H19的BM4细胞中,作者通过体外磷酸化以及免疫组化染色实验,发现其中的p38蛋白以及其下游的转录因子ATF2的磷酸化水平均降低了;反之,在H19敲低的BM4细胞中,这两种蛋白的磷酸化水平则升高(下图)。
使用siRNA干扰技术以及p38MAPK的抑制剂SB203580来抑制p38MAPK信号通路,结果同样导致了OPG表达量的下调(下图C)。而在H19敲低的BM4细胞中使用siRNA干扰p38MAPK,则可回补H19敲低所造成的OPG表达上调(下图D)。
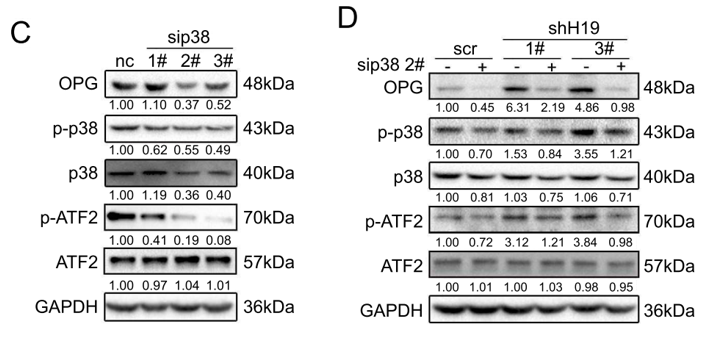
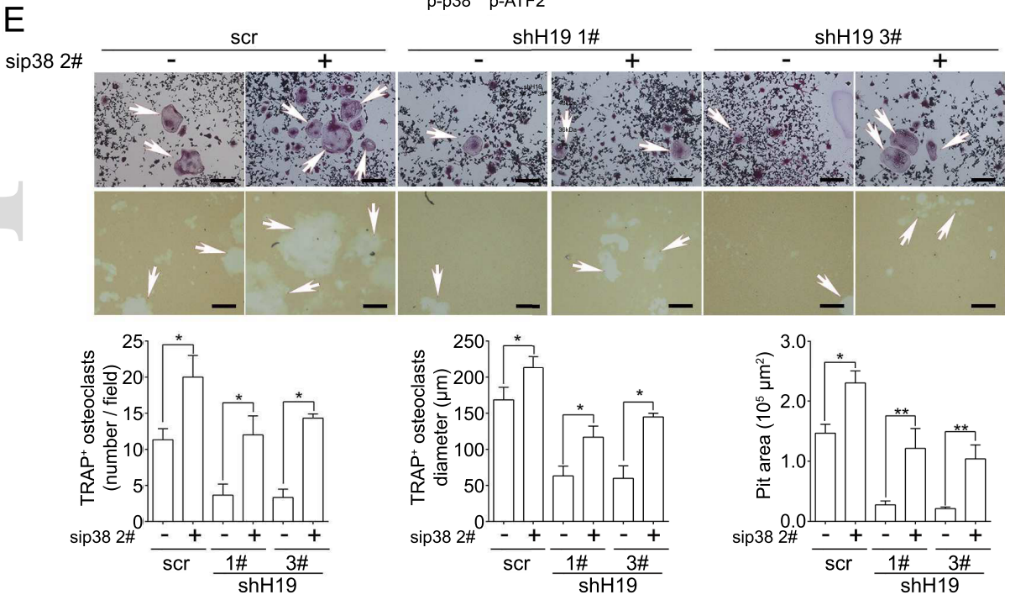
用RAW264.7细胞观察破骨细胞生成/溶骨情情况,发现H19敲低细胞所表现的破骨细胞生成以及溶骨减缓特性,均可被p38MAPK干扰技术回补至与对照组相似的水平(下图)。
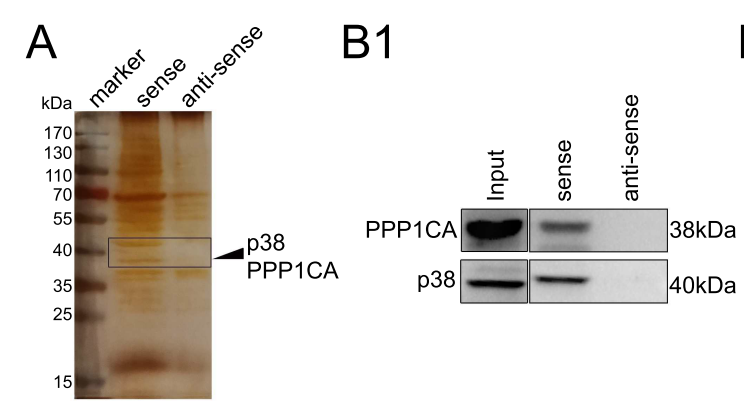
H19促进了PPP1CA 与 p38的相互作用
在证明了H19是通过p38MAPK通路抑制OPG的表达后,那H19调控p38MAPK的机制是什么呢?
通过RNA pull-down 和质谱实验,作者寻找到了H19的结合蛋白:除p38外,H19还特异性地与丝氨酸/苏氨酸特异蛋白磷酸酶1(PP1)的一个催化亚基PPP1CA相结合(下图)。
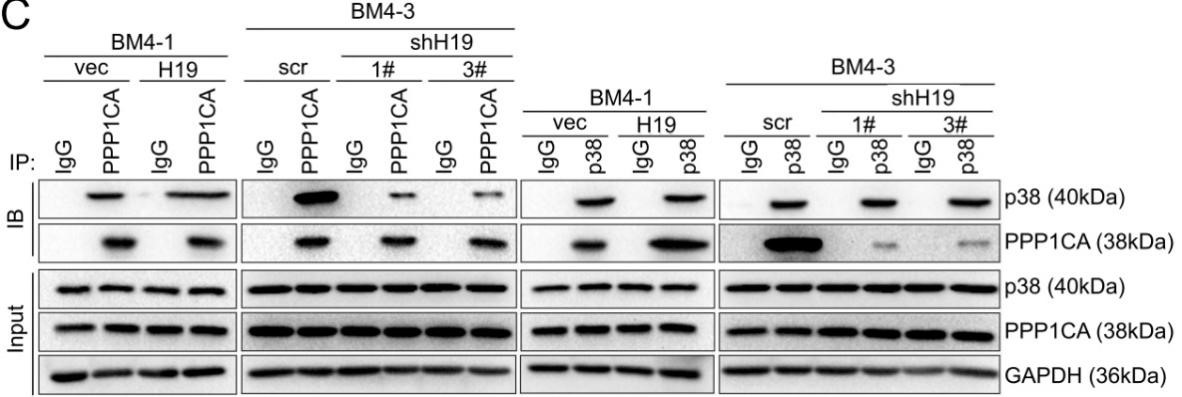
免疫共沉淀实验表明在BM4细胞中,过表达H19可促进PPP1CA 与 p38的结合,而敲低H19则会阻碍两者间的结合,说明H19起着促进PPP1CA 与 p38相互作用的功能(下图)。
PPP1CA是磷酸酶的亚基,故而作者检测了p38的磷酸化水平是否受PPP1CA的影响。结果显示,p38的磷酸化水平以及OPG的表达量均受到PPP1CA的负调控(下图D1)。另外,PP1的抑制剂冈田软海绵酸(OA)处理BM4细胞可以提高其中p38的磷酸化水平(下图D2)。体外磷酸化实验则确定了PPP1CA可直接催化p38的去磷酸化(图D3)。
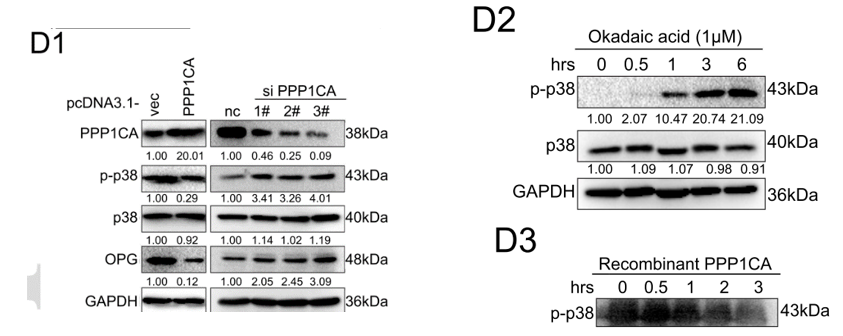
过表达H19造成的p38去磷酸化和OPG表达下调,可以通过敲低PPP1CA回补。而敲低H19造成的p38磷酸化和OPG表达上调,可以通过过表达PPP1CA挽救(下图)。这表明H19依赖于PPP1CA来调控p38的磷酸化水平。
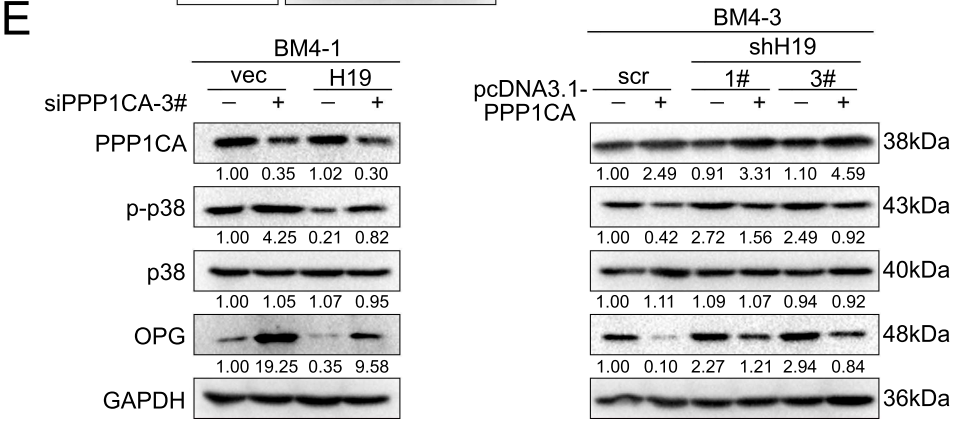
SB203580可以在体内增强H19所介导的HCC骨转移
为了确定体内p38MAPK通路与HCC骨转移之间的关系,作者给小鼠服用了抑制剂SB203580,并心内注射BM4细胞,发现SB203580处理组(SB)小鼠全部产生了HCC骨转移症状(7/7),而对照组(PBS)中产生骨转移的小鼠仅为3/7,并且处理组小鼠的肿瘤负荷也显著大于对照组(下图)。
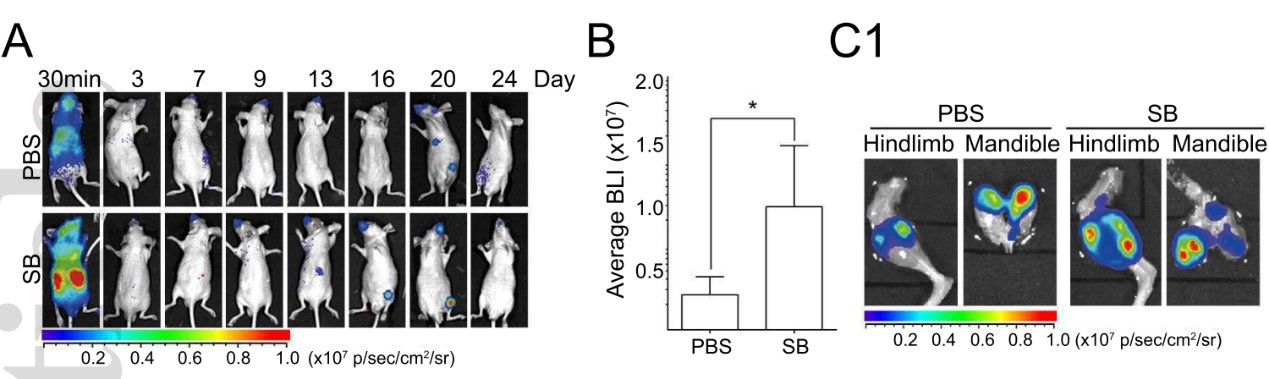
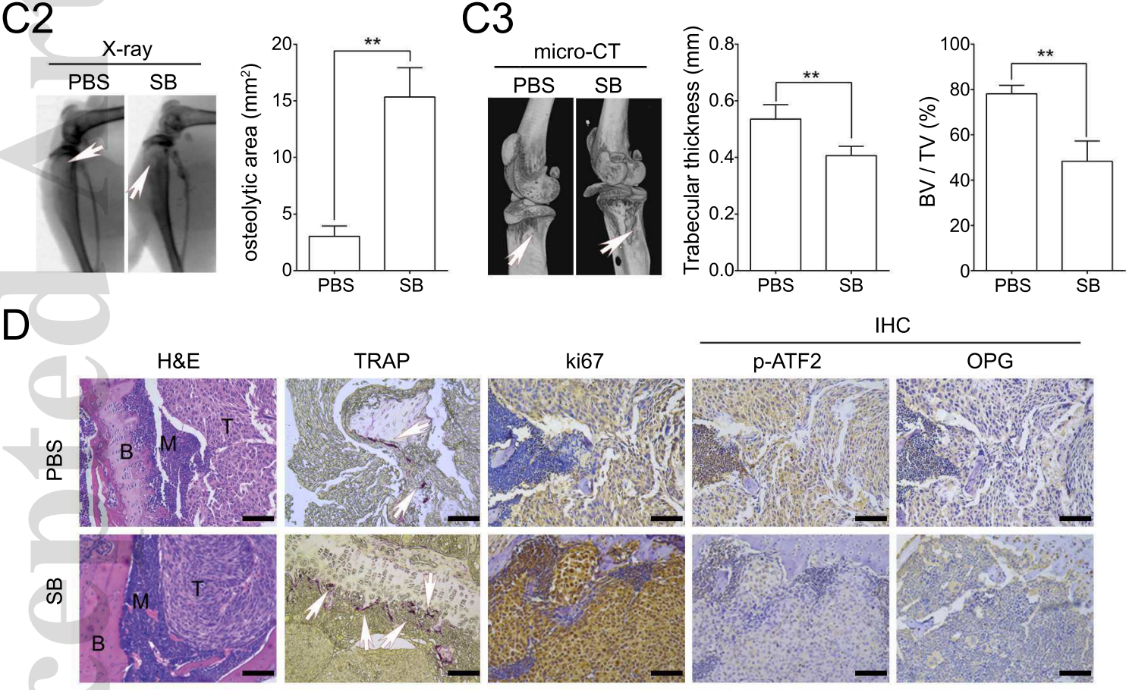
影像学和免疫组学染色的结果表明,SB203580处理会加快破骨细胞形成,恶化HCC骨转移所造成的溶骨症状。同时,在骨骼中ATF2的磷酸化和OPG的表达也被SB203580处理所抑制(下图)。
H19通过抑制miR-200b-3p的表达来促进HCC细胞的上皮间质转化(EMT)
通过转录组测序数据的GO富集分析以及GSEA富集分析,作者注意到受H19调控的基因在与细胞黏附性分子结合相关有富集,故而猜想H19可能影响了HCC细胞BM4的迁移能力。

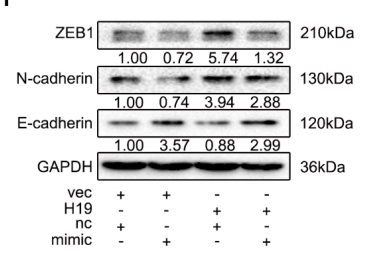
为了验证猜想,作者分别检测了过表达H19和敲低H19的BM4细胞迁移能力,发现H19表达量升高的确可以促进BM4细胞的迁移,反之则抑制迁移(下图)。

上皮间质转化(EMT)会使细胞降低黏附性,增强运动能力,是癌细胞转移的“推手”,作者检测了EMT标志蛋白表达量,结果显示几种与EMT负相关的标志蛋白(E-cadherin和ZO-1)表达量受H19负调控,而正相关标志蛋白(N-cadherin和ZEB1)则受H19正调控(下图)。
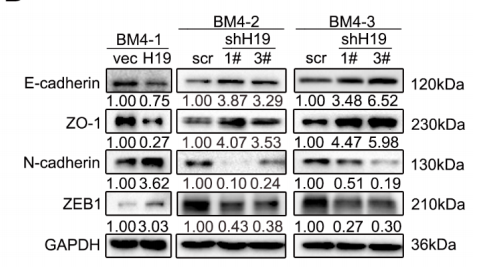
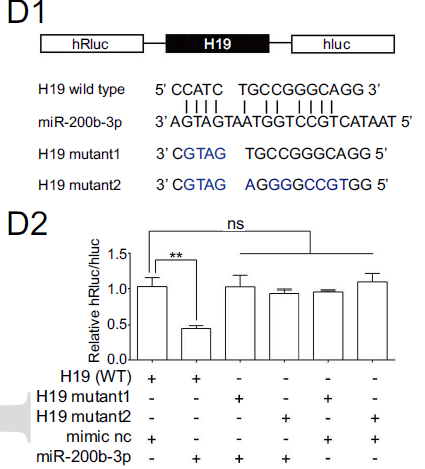
通过生信预测分析,发现H19具有结合小RNA家族miR-200成员的结合位点,而这一miRNA家族成员已被报道具有抑制EMT进程的能力。通过qRT-PCR,作者验证了H19的表达对于miR-200b-3p起到负调控作用(下图)。

而通过双荧光素酶报告基因实验,作者确认了H19可以特异性地与miR-200b-3p直接结合。
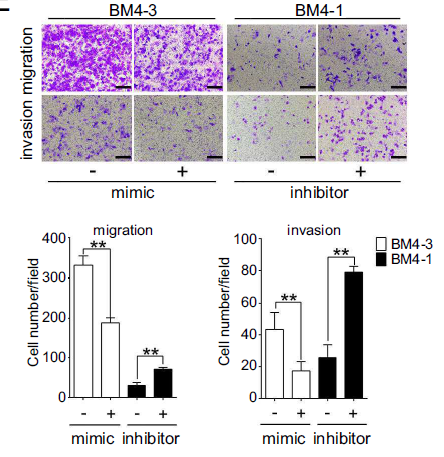
过表达miR-200b-3p可以抑制BM4细胞的迁移入侵能力,反之,miR-200b-3p抑制剂处理的BM4细胞表现出更强的迁移入侵能力(下图左)。过表达H19对EMT标志蛋白表达的影响,也可以通过miR-200b-3p mimic回补至对照组的水平(下图右)。综上所述,可以确认H19促进HCC细胞EMT过程主要是通过抑制miR-200b-3p来实现的。
H19在其他HCC细胞系或其他癌细胞中高表达且促进癌细胞的骨转移
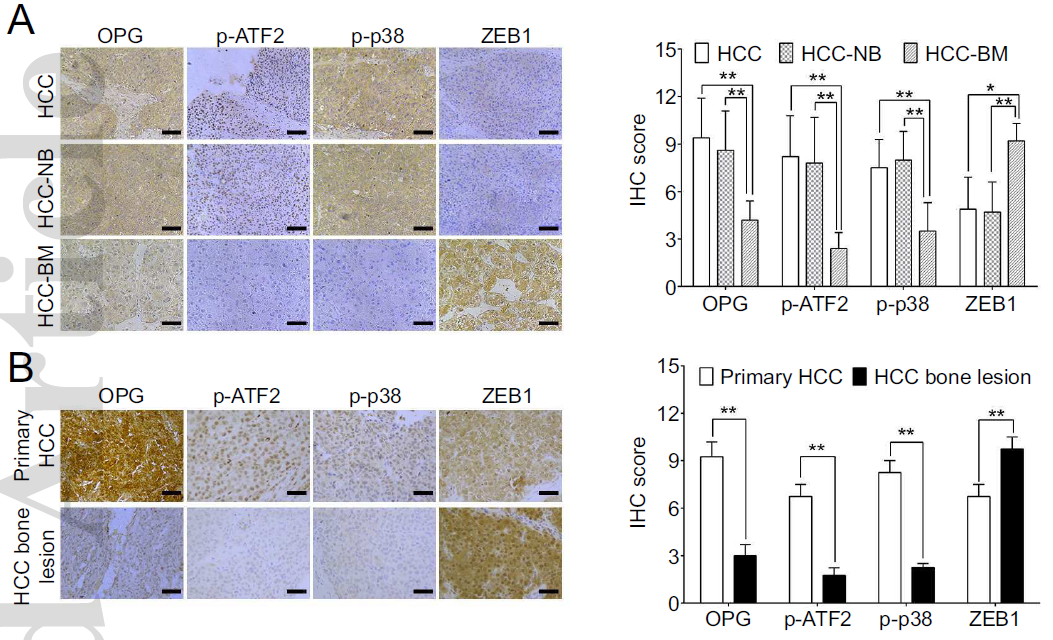
前面的研究结果主要是通过小鼠实验得到。为了进一步验证H19的功能,作者选取HCC患者的组织进行实验。免疫组化染色结果与小鼠实验结果一致:p38,ATF2的磷酸化水平以及OPG的表达量在发生了骨转移的HCC患者组织中较之于未发生骨转移的患者更低。而EMT正相关标志蛋白ZEB1表达量则高于未转移患者(下图A)。此外,对比HCC骨病变组织和原发HCC,也得到类似的结果(下图B)。
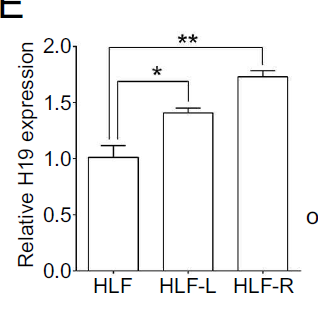
为了验证H19促进HCC骨转移的作用是否“广谱”,作者选用了其他HCC细胞系(HLF),给裸鼠心内注射,发现之后分离到的骨转移细胞(HLF-L和HLF-R)中H19表达量显著高于HLF细胞,这说明H19的表达增强了HCC细胞骨转移能力。
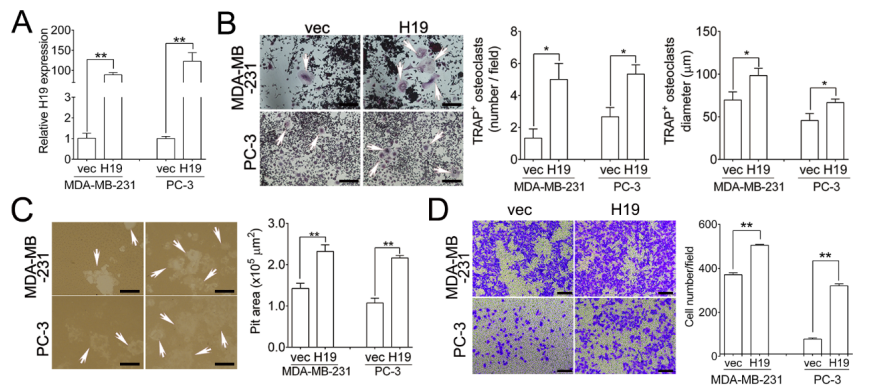
作者还选用其他种类的癌细胞系,在乳腺癌细胞系MDA-MB-231以及前列腺癌细胞系PC-3中过表达H19,结果发现这些癌细胞系的骨转移,破骨细胞生成,溶骨症状等均伴随H19过表达而恶化。这些结果说明H19具有广泛的促进癌细胞骨转移以及后续病症恶化的特性。
综上所述,LncRNA-H19主要通过两条路径来促进HCC骨转移以及后续病症恶化:一是通过介导PPP1CA与p38相互作用,促进p38MAPK通路的去磷酸化,进而抑制下游的OPG基因表达,而OPG基因表达的下调,最终导致破骨细胞生成,加剧溶骨症状;另一方面,H19通过与miR-200b-3p的特异性结合来下调miR-200b-3p表达量,从而解除miR-200b-3p对癌细胞EMT进程的抑制,进而增强HCC的迁移潜能和转移能力(下图)。

统观整篇文章,可以发现很明显的一个特点:实验设计思路清晰,验证充分可靠,很清楚地阐述了H19对于HCC骨转移的促进作用以及其机制。
而且值得一提的是,这篇文章的主角--H19正是通过对HCC骨转移细胞进行转录组测序以及后续数据分析,从而进入了作者的视野,并且转录组数据还在后续实验中为作者提供了研究方向的可靠参考。由此可见,高质量的转录组以及可靠的数据分析仍是推进实验、助力文章冲刺高分期刊的有力工具!
- 本文固定链接: https://www.maimengkong.com/moreshare/1337.html
- 转载请注明: : 萌小白 2023年1月13日 于 卖萌控的博客 发表
- 百度已收录
