一、研究背景
lncRNA起初被认为是基因组转录的“噪音”,是RNA聚合酶II转录的副产物,不具有生物学功能。然而,有文献研究表明,lncRNA参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等多种重要的调控过程。lncRNA的这些调控作用也开始引起人们广泛的关注。
西班牙IMIM(Hospital del Mar Medical Research Institute)和加泰罗尼亚理工大学(UPC)的研究团队最近在eLife杂志上发表研究指出,长非编码RNA在新蛋白演化中起到了重要的作用,它们在细胞中有着不为人知的重要功能。长非编码RNA是指长度超过三百个核苷酸的RNA分子,其上没有编码蛋白的阅读框。在细胞内lncRNA的丰度约占到70%至98%,有些lncRNA甚至长达几千bp。虽然lncRNA没有编码任何蛋白质,但它们的表达在不同组织和发育阶段依然具有特异性,这说明lncRNA具有重要的生物学意义。绝大多数lncRNA位于细胞核,它们对应的DNA区域有的与蛋白编码基因重叠,有的位于基因之间或者内含子中。由于lncRNA似乎没有承担什么生物学功能,它们曾被认为是一种“进化噪声”。现在西班牙的研究人员通过新测序技术向人们展示,许多这样的转录本也有机会翻译成为蛋白。这一发现旋即引起了激烈的争论。
1.lncRNA特点
lncRNAs通常较长,具有mRNA样结构,经过剪接,通常在5’端有一个7mC的帽子,3’端可以带polyA也可以不带polyA的尾巴。分化过程中有动态的表达与不同的剪接方式。
有组织特异性与时空特异性,不同组织之间的lncRNA表达量不同,同一组织或器官在不同生长阶段,其中的lncRNA表达量也会变化。如有人针对小鼠的1300个lncRNA进行研究,发现在脑组织中的不同部位,lncRNA具有不同的表达模式。
调控多样性,lncRNA可从染色质重塑、转录调控及转录后加工等多种层面实现对基因表达的调控。lncRNAs启动子同样可以结合转录因子,如Oct3/4,Nanog, CREB, Sp1, c-myc, Sox2与p53,局部染色质组蛋白同样具有特征性的修饰方式与结构特征。
序列上保守性较低,只有约12%的lncRNA可在人类之外的其它生物中找到。
哺乳动物蛋白编码基因占总RNA的1%,长链非编码RNA占总RNA的比例可达4%-9%,这些长链非编码RNA是基因功能研究的又一座宝库。目前发现的许多lncRNA都具有保守的二级结构,一定的剪切形式以及亚细胞定位。2.lncRNA的分类
它们在基因组上相对于蛋白编码基因的位置,可以分为5种:正义链(sense)、反义链(antisense)、双向(bidirectional)、内含子间(intronic)、基因间(intergenic),其所在的位置与其功能有一定的相关性。
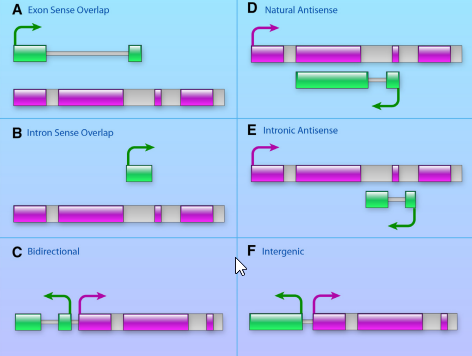
链非编码RNA(lncRNA)是一类转录本长度超过200nt的RNA分子,它们并不编码蛋白,而是以RNA的形式在多种层面上(表观遗传调控、转录调控以及转录后调控等)调控基因的表达水平。
结构不同进行分类。
1) Sense lncRNA lncRNA与exon有overlap。这些lncRNAs是编码蛋白质的基因转录变异体,他们重叠与已知基因相同的基因链。大多数的lncRNAs缺乏蛋白质翻译的开放阅读框(ORF),而这类lncRNA包含一个开放阅读框,与编码基因有相同的起始密码子,但不能编码蛋白质的原因可能是介导衰变(NMD)限制mRNA的翻译并使终止密码子提起翻译。或是ORF上游有两个ORF,其中一个终止另一个ORF的翻译。
2) Intronic lncRNA 内含子lncRNA,大多数的内含子lncRNAs具有相同的组织表达模式和相应的编码基因,可使编码基因稳定转录或调节编码基 因的可变剪接。
3) Bidirectional lncRNA 双向lncRNA 与编码基因的上游的1kb内的头对头的区域。这类双向lncRNA与对应的编码蛋白有相似的表达模式。表明他们共享双向剪切。这种模式使得lncRNA可以“打开”染色质促进相邻编码基因的表达。
4) Antisense lncRNA 相比于正常的转录本,能减少更少的可变剪切。
5) Intergenic lncRNA 定位于距离编码基因至少1kb的基因间区。参与细胞周期调控、免疫监视与胚胎干细胞多能性等功能。
3.lnc的调控
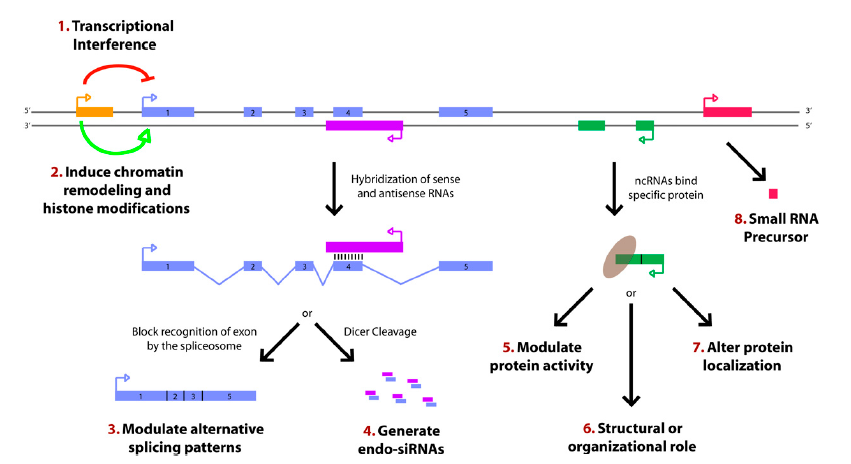
1) 编码蛋白的基因上游启动子区(橙色)转录,干扰下游基因(蓝色)的表达;
2) 抑制RNA聚合酶II或者介导染色质重构以及组蛋白修饰,影响下游基因(蓝色)的表达
3) 与编码蛋白基因的转录本形成互补双链(紫色),干扰mRNA的剪切,形成不同的剪切形式
4) 与编码蛋白基因的转录本形成互补双链(紫色),在Dicer酶的作用下产生内源性siRNA;
5) 与特定蛋白质结合,lncRNA转录本(绿色)可调节相应蛋白的活性;
6) 作为结构组分与蛋白质形成核酸蛋白质复合体
7) 结合到特定蛋白质上,改变该蛋白质的细胞定位;
8) 作为小分子RNA(如miRNA、piRNA)的前体分子。
4. 调控机制
4.1lncRNA参与转录前调控
对录事件发生之前的准备阶段进行调控,主要指对染色质开放或关闭状态的调控。染色质的状态由表观修饰因子(本质上是蛋白质)决定:富含H3K4me3、H3K36me3及组蛋白乙酰化等激活型组蛋白修饰的为开放状态;富含H3K9me3、H3K27me3、H4K20me3及DNA甲基化等抑制型组蛋白修饰的为关闭状态。lncRNA的其中一部分区域与DNA结合,然后其他部分折叠成高级结构,与表观因子结合,从而影响转录。
常见的转录后修饰是lncRNA通过调节DNA甲基化或羟甲基化,以及组蛋白乙酰化或甲基化作用,从而调控下游分子的转录。
4.1.1 lncRNA调控组蛋白修饰
4.1.1.1组蛋白乙酰化
组蛋白乙酰化修饰是表观遗传学研究的重要组成部分之一,与基因活化密切相关。组蛋白乙酰化水平增高有利于降低组蛋白与DNA 之间的亲和作用,使染色质核小体结构松散,利于转录因子与DNA 结合继而促进相应基因的转录和表达,而乙酰化水平降低则发挥相反的作用。其中,组蛋白H3( histone 3,H3) 和组蛋白H4( histone 4,H4) 氨基末端的赖氨酸残基乙酰化修饰对转录尤为重要。组蛋白乙酰化修饰由组蛋白乙酰化酶和组蛋白去乙酰化酶( histone deacetylase,HDAC) 共同调控。
4.1.1.2 组蛋白甲基化
参考文献:[组蛋白甲基化]Long Noncoding RNA TARID Directs Demethylation and Activation of the Tumor Suppressor TCF21 via GADD45A
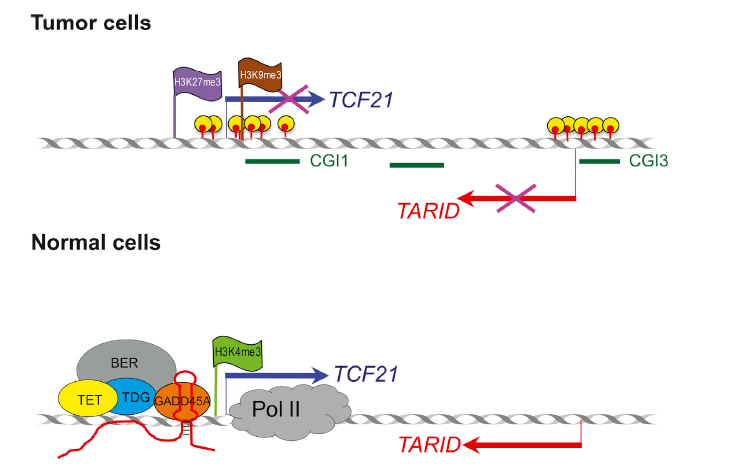
在癌细胞中,TCF21和TARID的启动子通常都是超甲基化的,甲基化TCF21隐藏了RNAP II 和 H3K4me3的活力。lncRNA-TARID与GADD45A结合,募集TET、TDG、BER通过碱基剪切修复使得TCF21启动子区去甲基化。从而使TCF21得以表达。
4.1.2 lncRNA调控DNA甲基化修饰
DNA胞嘧啶甲基化是一种重要的维持基因组完整性和调控基因表达的表观遗传修饰
相对于在哺乳动物中的DNA甲基化过程,植物中的DNA甲基化机制更加复杂。植物中DNA甲基化主要是通过RNA干扰导致基因转录沉默的过程完成该过程。在哺乳动物中研究人员发现lncRNA能够招募DNA甲基转移酶Dnmt1,Dnmt3a,Dnmt3b到其靶基因的启动子上,从而在该lncRNA对应的靶基因上完成甲基化功能。
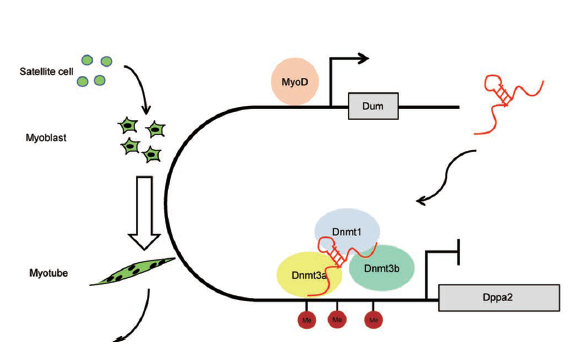
研究人员在小鼠的骨骼肌干细胞向成肌细胞分化过程中发现一类lncRNA能够招募甲基转移酶Dnmt1,Dnmt3a和Dnmt3b到其靶基因上,导致靶基因的甲基化从而调控其靶基因的表达。LncRNA-Dum是小鼠骨骼肌成肌细胞中发育和多能性相关蛋白2(Dppa2)基因上游的转录产物,可由MyoD诱导转录。研究发现lncRNA-Dum能够启动成肌细胞分化,Dum可以顺式调控它的临近的基因Dppa2的沉默。基于此基础上,研究人员提出了小鼠中lncRNA介导的DNA甲基化模型:在小鼠成肌细胞分化时会产生一类蛋白MyoD可以诱导Dppa2基因上游转录产生lncRNA-Dum,Dum结合到其下游靶基因Dppa2上,随后Dum招募DNA甲基转移酶Dnmt1,Dnmt3a,Dnmt3b到Dppa2基因的启动子上,并激活Dnmt1,Dnmt3a,Dnmt3b的活性,在Dppa2基因启动子上的CpG位点添加甲基,从而导致基因Dppa2基因的沉默。
转录调控是指对转录过程的调控。这里讨论的是RNA pol II参与的II类启动子的转录。转录过程分为起始(Initiation)、延伸(Elongation)和终止(Termination) 3个过程。
转录起始过程是RNA pol II在核心转录因子(TBP、TFIIB、TFIIE、TFIIF等)帮助下与核心启动子结合,DNA局部解旋,合成9nt的RNA,由于RNA pol II的C末端结构域(C terminal domain,CTD)磷酸化水平很低,因此转录暂停。
转录延伸过程是结合于增强子序列的转录因子(Transcription factors,TFs)使RNA pol II的CTD高度磷酸化,转录过程迅速延伸(磷酸化水平决定延伸速度)。
转录终止过程是poly A信号位点AATAAA(或ATTAAA)被转录为AAUAAA(或AUUAAA)的RNA序列后,延伸复合体里面的转录终止因子CSTF (切割刺激因子,Cleavage stimulation factor)和CPSF (切割及多聚腺苷酸化特异因子,Cleavage and polyadenylation specificity factor)迅速与AAUAAA(或AUUAAA)结合,并在其之后11-50nt处切断RNA,然后催化末端加上一串的A (大家可以观察一下mRNA序列,一般在AATAAA(或ATTAAA)之后11-50nt后出现一连串的A)。RNA被切断后转录活性下降,再加上polyA信号位点AATAAA(或ATTAAA)之后的序列富含T或GT,很容易导致延伸复合体解散。
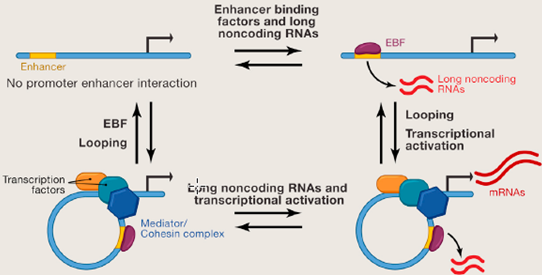
LncRNA具有促进增强子环化和激活基因表达的功能。在没有成环的情况下(左上)增强子处于非活性状态。模型一:链接因子、转录因子、桥接因子等与增强子和转录起始序列成环形。lncRNA诱导靶基因的转录与表达。模型二:lncRNA诱导链接因子、转录因子、桥接因子结合到靶基因周围,诱导靶基因的转录与表达。
4.2.2 lncRNA调控绝缘子功能
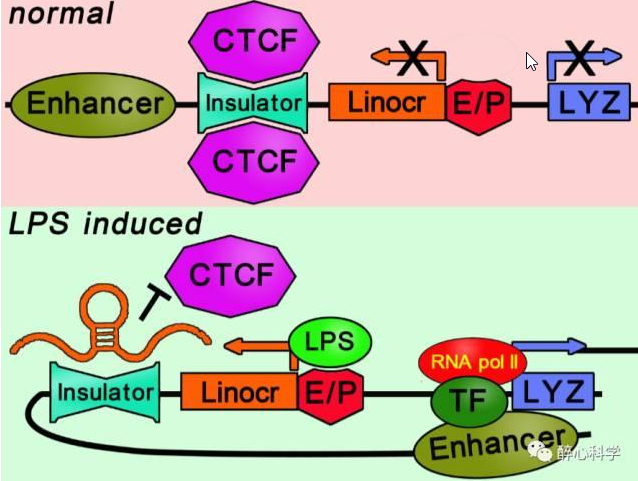
Lefevre等的研究表明,LINoCR (脂多糖诱导的lncRNA,lipopolysaccharide inducible non-coding RNA)在脂多糖(lipopolysaccharide,LPS)诱导鸡溶菌酶(Lysozyme,LYZ)表达的过程中,起到关键作用。正常情况下,LYZ上游绝缘子结合CTCF(CCCTC结合因子),进而募集粘性蛋白,抑制增强子的功能,LYZ处于沉默状态;加入LPS诱导后,LINoCR转录,导致绝缘子不再与CTCF结合,解除了绝缘子对增强子的抑制作用,激活LYZ的表达。
4.2.3lncRNA的转录干扰功能
LncRNA可调控邻近基因的转录。LncRNA的自身转录会干扰其邻近编码蛋白的基因的转录。上游lncRNA转录时,会穿越邻近靶基因的启动子区,干扰了转录因子与靶基因的启动子结合,从而抑制靶基因的转录,如在酵母中,SER3基因转录会受到上游lncRNA基因SRG1的转录的影响。
4.2.4 lncRNA控制转录因子
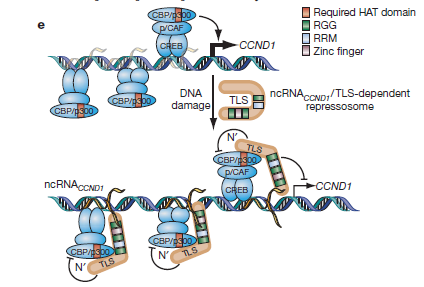
LncRNA能够与转录因子相互作用调控基因转录。LncRNA可招募转录调节因子至靶基因的启动子区,调节靶基因转录。例如,细胞周期蛋白D1基因(cyclinD1,CCND1)的5'端调控序列在辐射等DNA损伤信号下转录生成一种lncRNA。这个lncRNA可募集RNA结合蛋白-脂肪肉瘤易位(translocatedinliposarcoma,TLS)到CCND1启动子区,然后与环磷酸腺苷应答元件结合蛋白的结合蛋白(cAMPresponseelementbindingprotein-bindingprotein,CBP)和组蛋白乙酰转移酶P300结合,并抑制这两个蛋白的活性,进而抑制CCND1基因的表达[转录因子1];
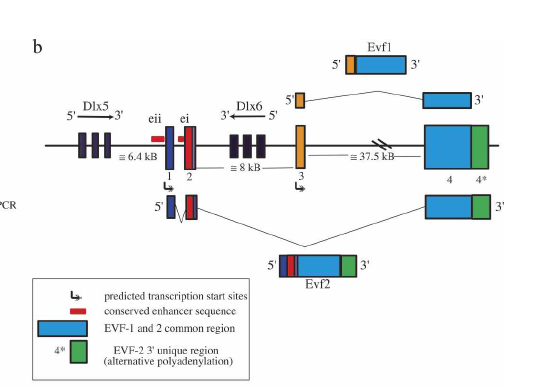
lncRNA还能调节转录因子的活性,例如胚腹前脑-2(embryonicventralforebrain-1,Evf-2)这个由位于远端缺失同源异形盒-5/6(distal-lesshomeobox-5/6,Dlx-5/6)基因间的一个超保守增强子转录出的3.8kb的lncRNA。Evf2能够与转录因子Dlx2形成转录复合体从而增强Dlx-5/6的表达[转录因子2]
4.3.lncRNA参与转录后调控
4.3.1lncRNA参与可变剪切调控
lncRNA 不但在转录调控中发挥作用, 而且是mRNA 前体剪接的调控因子。果蝇中的热休克RNAω-n(Heat shock RNA ω-n,hsrω-n)和人类中的卫星Ⅲ(Satellite Ⅲ, sat Ⅲ )重复序列的转录物通过隔离剪接因子调控mRNA 前体的剪接。另一种被称为肺腺癌转移相关转录物1(Metastasis-associated in lungadenocarcinoma transcript 1, MALAT1)的lncRNA 已被发现在多种癌症中异常表达, 它由其初级转录物的3端加工而来, 主要位于剪接斑点(Splicing speckle)。它与丝氨酸/精氨酸(Serine/arginine, SR)剪接因子相互作用, 并调控剪接因子在剪接斑点中的分布和磷酸化水平, 从而改变mRNA 前体的选择性剪接模式(下图)。Bernard 等发现,MALAT1 在神经元中是高表达的, 它通过调控SR 剪接因子影响突触形成相关基因的表达。此外, MALAT1 还与剪接因子反式激活应答DNA 结合蛋白-43(Transactive response DNAbinding protein-43, TDP-43)相互作用, 影响mRNA前体的选择性剪接。
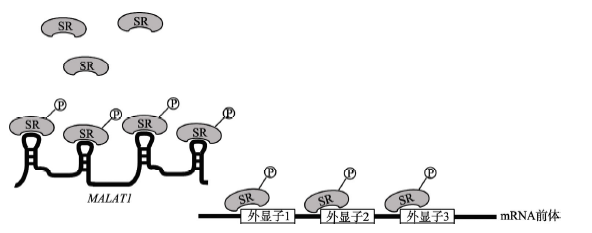
4.3.2lncRNA介导RNA降解
lncRNA可介导mRNA的降解,mRNA的丰度直接影响蛋白质的产量,其中介导mRNA降解的重要途径为无义介导的mRNA降解(Nonsense-mediatedmRNAdecay,NMD)。例如,一种被称为半Stau1结合位点RNA(Half-Stau1-bindingsiteRNA,1/2-sbsRNA)的lncRNA可通过与靶mRNA的3'-UTR的Alu元件形成不完全互补配对,形成Stau1的结合位点,促进Stau1与mRNA结合,进而导致mRNA的降解。
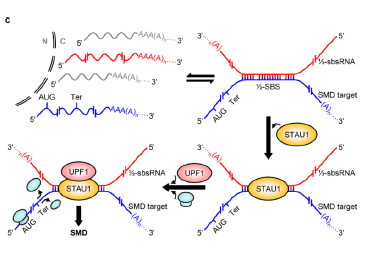
4.3.3 lncRNA参与RNA稳定性调控
BACE1-AS是与BACE1(β-淀粉样蛋白前体裂解酶1,beta-site
amyloid precursor protein cleaving enzyme
1)部分互补的lncRNA,阿尔茨海默病患者的BACE1-AS水平高于正常人。BACE1-AS能与BACE1形成RNA双螺旋结构,从而增加了BACE1的稳定性,促使APP(淀粉样蛋白前体,amyloid
precursor protein)降解为Aβ 1-42(淀粉样蛋白β 1-42 ,amyloid-β 1-42)),Aβ
1-42则通过正反馈机制促进BACE1-AS转录,从而最终导致Aβ 1-42沉积,引起阿尔茨海默病。
第二部分 常见技术及原理
1.RT-PCR(reverse transcription-polymerase chain reaction, RT-PCR)
由一条RNA单链转录为互补DNA(cDNA)称作“逆转录”,由依赖RNA的DNA聚合酶(逆转录酶)来完成。随后,DNA的另一条链通过脱氧核苷酸引物和依赖DNA的DNA聚合酶完成,随每个循环倍增,即通常的PCR。原先的RNA模板被RNA酶H降解,留下互补DNA。
RT-PCR的指数扩增是一种很灵敏的技术,可以检测很低拷贝数的RNA。RT-PCR广泛应用于遗传病的诊断,并且可以用于定量监测某种RNA的含量。
RT-PCR的关键步骤是在RNA的反转录,要求RNA模版为完整的且不含DNA、蛋白质等杂质。常用的反转录酶有两种,即鸟类成髓细胞性白细胞病毒(avian myeloblastosis virus,AMV)反转录酶和莫罗尼鼠类白血病病毒(moloney murine leukemia virus,MMLV)反转录酶。
2.qPCR
Real-time-PCR和 qPCR(Quantitative Real-time-PCR)是一码事,都是实时定量PCR,指的是PCR过程中每个循环都有数据的实时记录,因此可以对起始模板数量进行精确的分析。
3.RT-qPCR(Real-time Quantitative PCR)
实时荧光定量PCR 就是在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR扩增反应中每个循环扩增产物量的变化,最后通过Ct值和标准曲线的分析对起始模版进行定量分析的方法。
一般分为两类,一类为染料类,包括如SYBR Green I、Eva Green等,通过荧光染料来指示产物的增加;一类为探针类,包括TaqMan探针和分子信标探针等,利用与靶序列特异杂交的探针来指示扩增产物的增加。
一:SYBR Green法
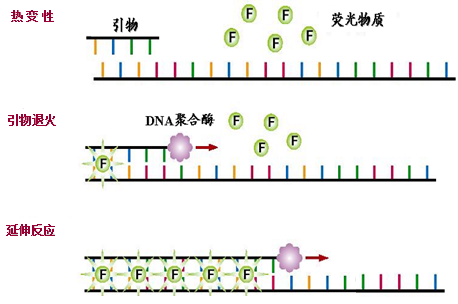
SYBR Green I是一种结合于双链DNA小沟中的染料。与双链DNA结合后,其荧光大大增强,这一性质使其用于扩增产物的检测非常理想。SYBRGreen I的最大吸收波长约为497nm ,最大发射波长约为520nm。在PCR反应体系中,体系中的SYBR Green荧光染料掺入DNA双链后发射出荧光,并且荧光的强度与体系中双链的浓度成正比,从而保证了荧光信号的增加与PCR产物的增加完全同步,荧光的强度就代表了体系中双链产物的浓度。
特点:
优点:成本低,不需要探针;准备时间和实验时间短,操作简单;可以制作熔解曲线来确定PCR产物是否特异、有无引物二聚体。
缺点:无法多重检测,只能检测一个目标基因;无模板特异性,只能给出总信号,对引物的特异性要求较高;灵敏度低,目的片段需在5000拷贝以上。
应用:一般应用于相对定量分析。最适合初步筛查,即先用SYBR Green方法筛查,得到初步结果后再用TaqMan精确定量
二:TaqMan探针法
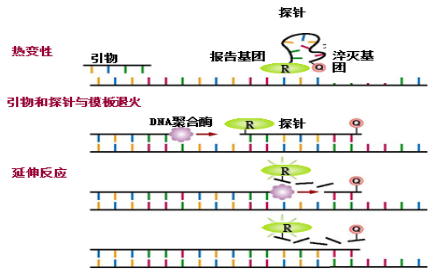
原理是:PCR扩增时加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸:5’端标记一个报告荧光基团,3’端标记一个淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收,不会检测到荧光;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号。每扩增一条DNA链,就有一个荧光分子形成,也同样实现了荧光信号的累积与PCR产物形成完全同步。
特点:
优点:特异性高,探针提供了额外的特异性;准确性高,可给出特异模板的荧光信号;可应用于多重定量。
缺点:成本较高,合成探针费用较贵,等待时间长。
应用:一般应用于绝对定量分析,MGB探针等可应用于SNP的检测。
4. QD-FISH 原位杂交技术
基本原理:被检测的染色体或DNA纤维切片上的靶DNA与所用的核酸探针是同源互补的,二者经变性-退火-复性,即可形成靶DNA与核酸探针的杂交体。将核酸探针的某一种核苷酸标记上报告分子如生物素、地高辛,可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应,经荧光检测体系在镜下对待测DNA进行定性、定量或相对定位分析。
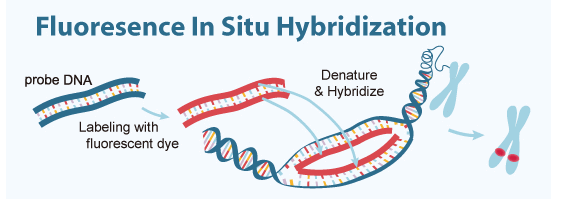
优势::① 安全、快速、灵敏度高;② 探针能较长时间保存;③ 多色标记,简单直观;④ 可用于中期染色体及间期细胞的分析;⑤ 可应用于新鲜、冷冻或石蜡包埋标本以及穿刺物和脱落细胞等多种物质的检测。
应用:① 已知基因或序列的染色体定位;② 未克隆基因或遗传标记及染色体畸变的研究。
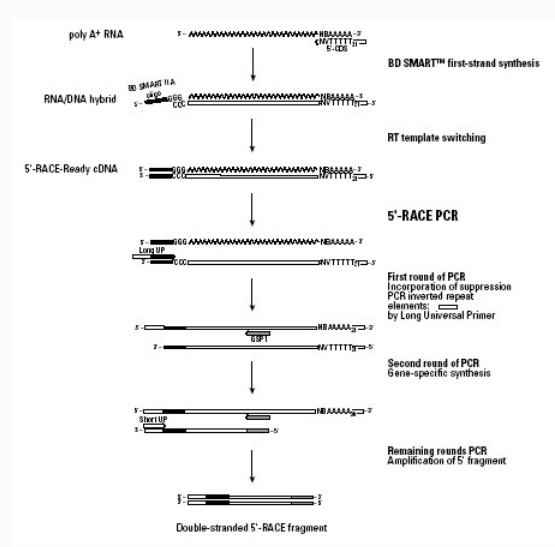
5. cDNA 末端快速扩增 (rapid amplification of cDNA ends,RACE)【参考文献:Rapid Amplification of cDNA Ends (RACE).pdf】
RACE技术是一种基于mRNA反转录和 PCR技术建立起来的、以部分的已知区域序列为起点,扩增基因转录本的未知区域,从而获得mRNA(cDNA)完整序列的方法。简单的说就是一种从低丰度转录本中快速增长cDNA5’和cDNA3’末端,进而获得获得全长cDNA简单而有效的方法,该方法具有快捷、方便、高效等优点,可同时获得多个转录本。因此近年来RACE技术已逐渐取代了经典的cDNA文库筛选技术,成为克隆全长cDNA序列的常用手段。
第二 RACE的原理
RACE 是采用PCR 技术由已知的部分cDNA 顺序来扩增出完整cDNA5’和3’末端,是一种简便而有效的方法, 又被称为锚定 PCR (anchoredPCR)和单边PCR(one2side PCR)。
3’RACE的原理
利用mRNA的3'末端的poly(A)尾巴作为一个引物结合位点,以连有SMART寡核营酸序列通用接头引物的Oligo(dT)30MN作为锁定引物反转录合成标准第一链cDNA.然后用一个基因特异引物GSP1(gene specific primer,GSP)作为上游引物,用一个含有部分接头序列的通用引物UPM(universal primer,UPM)作为下游引物,以cDNA第一链为模板,进行PCR循环,把目的基因3' 末端的DNA片段扩增出来。

5’RACE的原理
先利用mRNA的3'末端的poly(A)尾巴作为一个引物结合位点,以Oligo(dT)30MN作为锁定引物在反转录酶MMLV作用下,反转录合成标准第一链cDNA.利用该反转录酶具有的末端转移酶活性,在反转录达到第一链的5'末端时自动加上3-5个(dC)残基,退火后(dC)残基与含有SMART寡核苷酸序列Oliogo(dG)通用接头引物配对后,转换为以SMART序列为模板继续延伸而连上通用接头(见Figure 2 )。然后用一个含有部分接头序列的通用引物UPM(universal primer,UPM)作为上游引物,用一个基因特异引物2(GSP 2 genespecific primer,GSP)作为下游引物,以SMART第一链cDNA为模板,进行PCR循环,把目的基因5'末端的cDNA片段扩增出来。最终,从2个有相互重叠序列的3'/ 5'-RACE产物中获得全长cDNA,或者通过分析RACE产物的3'和5'端序列,合成相应引物扩增出全长cDNA。
6. RNA pull down(鉴定与目的lncRNA结合的蛋白配体)
RNA pull down 技术是检测 RNA 结合蛋白与其靶 RNA 之间相互作用的重要实验手段。利用体外转录法标记生物素 RNA 探针,然后与胞浆蛋白提取液孵育,形成 RNA-蛋白质复合物。该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。复合物洗脱后,通过 Western Blot 实验检测特定的 RNA 结合蛋白是否与 RNA 相互作用。
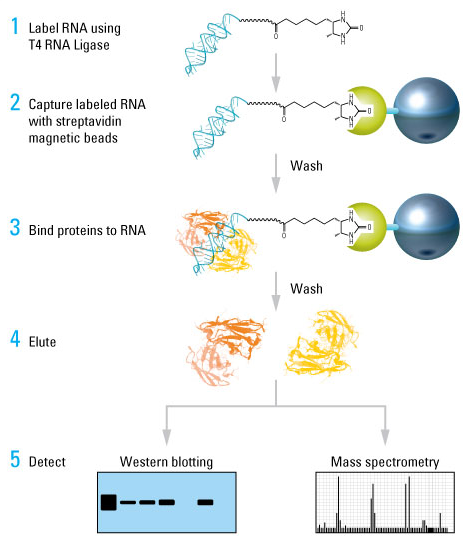
赛默飞世尔推出的Pierce Magnetic RNA-Protein Pull-Down Kit试剂盒原理图
试剂盒利用T4 RNA连接酶将单个脱硫生物素化的胞苷二磷酸连接到单链RNA的3’端。3’端的末端标记不干扰RNA结构,因此,比标记核苷酸的随机掺入更加理想。每个标记反应适合50 pmol RNA;不过,如有必要的话,标记反应也可扩展(从1 pmol到1 nmol)。标记反应需要20倍过量的脱硫生物素化核苷酸。对于不太复杂的RNA,孵育时间可为37°C 30分钟,若是更长或更复杂的RNA,时间也延长到4-16°C过夜。通过改变RNA与核苷酸的比例,延长孵育时间,或在标记反应中添加DMSO,可优化复杂RNA的标记效率。
RBP的富集过程经过优化,相当简单。首先将RNA与链霉亲和素磁珠结合。之后在蛋白质-RNA结合缓冲液中平衡RNA结合的磁珠,再加入蛋白裂解液。随后添加适当的缓冲液、涡旋振荡,并在磁力架上分离,洗涤磁珠。最后样品可通过非变性的生物素洗脱缓冲液或SDS-PAGE上样缓冲液洗脱,用于下游分析(如Western blotting和质谱(MS))。
7. RIP技术(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀)
RIP技术是研究细胞内RNA与蛋白结合情况的技术。运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析;即用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白,防止非特异性的RNA的结合(RIP反应体系中的试剂和抗体绝对不能含有RNA酶,抗体需经RIP实验验证等等),免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来,结合的RNA序列通过microarray(RIP-Chip),定量RT-PCR或 高通量测序(RIP-Seq)方法来鉴定。是了解转录后调控网络动态过程的有力工具,能帮助我们发现miRNA的调节靶点。
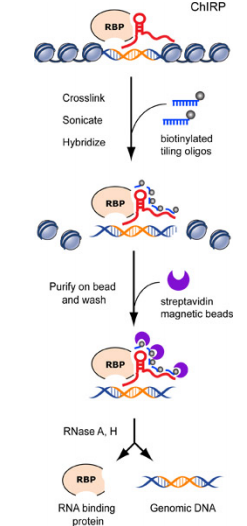
CHIRP-Seq 是一种检测与 RNA 绑定的 DNA 和蛋白的高通量测序方法。采用生物素和链霉亲和素探针把目标 RNA 拉下来后,则与其共同作用的 DNA 染色体片段就会附在磁珠上,最后把染色体片段做高通量测序,就会得到该RNA能够结合在基因组的哪些区域;如果结合物是蛋白质,可以将蛋白质打断成肽段进行质谱鉴定。
8. ChIRP( Chromatin Isolation by RNA Purification )
针对每个特定的lncRNA分子序列,按照100nt的步长设计长度为20个碱基长度的特异性反义核酸序列,并对所有序列进行编号,以奇数为一组,偶数为一组,合成末端修饰Biotin-TEG基团的lncRNA ChIRP probe。lncRNA ChIRP probe与交联的lncRNA分子复合物进行特异性杂交结合,通过末端修饰Biotin-TEG化学基团,利用链霉亲和素偶联的磁珠进行结合,纯化出目标lncRNA所结合的染色质复合体,最后从复合体中纯化出RNA、DNA和蛋白质用于后续的分析,以发现目标lncRNA的分子作用机制。【参考文献:chirp.pdf】
三.研究思路
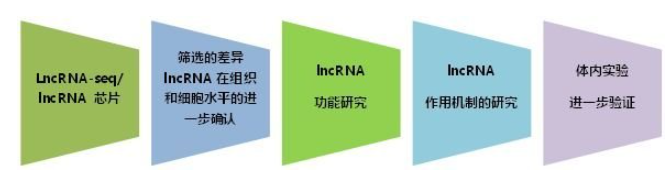
第一步 确定差异lncRNA表达
利用 RT-PCR 或者 RT-qPCR 检测 lncRNA 在不同细胞或者组织中的表达水平。
第二步 探究 lncRNA 特点
(1)通过 QD-FISH 原位杂交技术定位;或者通过细胞核质分离试剂盒得到 RNA,qRT-PCR 检测其分布;
(2)全长序列试验方法:通过 5′RACE 获取 lncRNA5′ 全长, 3′RACE 获取 lncRNA3′ 全长,最终得到 lncRNA 完整的全长序列。
第三步lncRNA的功能研究
lncRNA 较长,承载的信息量多,更容易形成高级结构,其功能具有多样化和特异性强的特点。类似于 miRNA,探讨 lncRNA 功能可用 gain/loss of function 策略,过表达或沉默 lncRNA 后观察表型。即研究 lncRNA 功能获得后或者功能缺失后对细胞增殖、凋亡、侵袭、转移与克隆形成,以及病毒的转录复制等的影响。
(1)功能获得性研究
构建 lncRNA 过表达质粒或者慢病毒、腺病毒包装载体。原则上是将全长 lncRNA 定向克隆到表达载体上实现 lncRNA 的过表达。然而有些 lncRNA 很大或全长尚未分离,这时将视 lncRNA 在基因组上的定位采取不同的研究策略。在构建 lncRNA 表达质粒时,需关注 lncRNA 是否在蛋白编码基因的启动子区域或 3′-UTR 区域,勿遗漏重要区段。
(2)功能缺失性研究
可用 siRNA、shRNA、反义核酸、CRISPR/Cas9 等方法沉默 lncRNA,经 qRT-PCR 或 FISH 等验证后观察其对疾病相关基因表达和对细胞表型等的影响。
第四步 机制研究
lncRNA 可与蛋白质、DNA 和 RNA 相互作用,但是目前最常用的还是利用体外转录、RNA pull down、RNA-RIP(RNA Binding Protein Immunoprecipitation)、CHIRP-seq(Chromatin isolation by RNA Purification)、MS 等技术手段。
第五步 表达调控
将 lncRNA 表达与其他领域相结合,解释其调控机理。(1)DNA 甲基化和乙酰化:可通过检测相应基因甲基化、乙酰化差异与 lncRNA 结合分析。(2)转录因子:研究 lncRNA 与转录因子的调控机制。
第六步 体内验证
有条件的实验室,可以继续在体内或者临床样本水平进行验证。
lncRNA的作用机制不清楚,lncRNA 的功能非常难研究。当前很多通过研究 miRNA 与 lncRNA 的调控关系来揭示非编码 RNA 的功能,最热门的要数 ceRNA 调控网络。相关的可利用资源包括:
(1)starBase 平台构建了最全面的 CLIP-Seq 实验支持的 miRNA 和 lncRNA 的调控关系网络,包括构建了 ceRNA 调控网络 。
(2)DIANA-LncBase 数据库 只是构建了基于单个 CLIP-Seq 数据的 miRNA 和 lncRNA 调控关系。
参考文献:
Arab, K., Park, Y. J., Lindroth, A. M., Schäfer, A., Oakes, C., & Weichenhan, D., et al. (2014). Long noncoding rna tarid directs demethylation and activation of the tumor suppressor tcf21 via gadd45a.Molecular Cell, 55(4), 604.
Thum, T., & Condorelli, G. (2015). Long noncoding RNAs and micrornas in cardiovascular pathophysiology. Circulation Research, 116(4), 751.
Wang, L., Zhao, Y., Bao, X., Zhu, X., Kwok, Y. K., & Sun, K., et al. (2015). Lncrna dum interacts with dnmts to regulate dppa2 expression during myogenic differentiation and muscle regeneration. Cell Research,25(3), 335.
James, W., Lylia, O., & Lefevre, P. F. (2013). A nf-κb-dependent dual promoter-enhancer initiates the lipopolysaccharide-mediated transcriptional activation of the chicken lysozyme in macrophages. Plos One, 8(3), e59389.
Gong, C., & Maquat, L. E. (2011). lncRNAs transactivate STAU1-mediated mRNA decay by duplexing with 3[prime] UTRs via Alu elements. Nature, 470(7333), 284-288.
Modarresi, F., Faghihi, M. A., Patel, N. S., Sahagan, B. G., Wahlestedt, C., & Lopeztoledano, M. A. (2011). Knockdown of bace1-as nonprotein-coding transcript modulates beta-amyloid-related hippocampal neurogenesis. International Journal of Alzheimer's Disease,2011,(2011-7-9), 2011(3), 929042.
Orom, U. A., & Shiekhattar, R. (2013). Long noncoding RNAs usher in a new era in the biology of enhancers. Cell, 154(6), 1190-1193.
Thebault, P., Boutin, G., Bhat, W., Rufiange, A., Martens, J., & Nourani, A. (2011). Transcription regulation by the noncoding rna srg1 requires spt2-dependent chromatin deposition in the wake of rna polymerase ii.Molecular & Cellular Biology, 31(6), 1288-300.- 本文固定链接: https://www.maimengkong.com/learn/1142.html
- 转载请注明: : 萌小白 2022年8月15日 于 卖萌控的博客 发表
- 百度已收录
