

特发性肺纤维化是一种慢性、进行性且最终致命的肺部疾病,其特征是肺功能不可逆性恶化,主要发生于50岁及以上人群 [ 1]。其病因及发病机制尚不明确,目前认为与遗传易感性、环境污染和职业暴露有关 [ 2]。特发性肺纤维化早期发病隐匿,病情逐渐加重,确诊时大多为疾病晚期,诊断后中位生存期仅有2~3年,且有研究表明15%特发性肺纤维化患者最终发展为肺癌 [ 3]。目前除肺移植外无任何其他治疗手段显示出生存获益,虽然近年来批准用于治疗特发性肺纤维化的药物(如吡非尼酮、尼达尼布)能有效减缓肺纤维化的进展,但不能完全阻止或者改善肺纤维化 [ 4]。因此明确特发性肺纤维化发生发展的相关基因靶点,并挖掘潜在的治疗中药,对特发性肺纤维化的临床诊断及治疗具有重大意义。
铁死亡是一种新型的细胞程序性死亡方式,与自噬和细胞凋亡不同,是一种依赖铁及活性氧的细胞死亡方式,其通常伴随脂质和铁代谢的紊乱 [ 5]。已有大量研究表明,铁代谢的异常与肺部疾病的发生发展有密切联系 [ 6-7],对特发性肺纤维化的进展亦有促进作用 [ 8]。本研究以铁死亡为切入点,探索铁死亡在特发性肺纤维化中的可能作用靶点,并预测潜在的具有治疗作用的中药,为特发性肺纤维化的诊治提供参考。
1方法
1.1数据的获得与处理
在GEO数据库(http://www.ncbi.nim.nih.gov/geo/)检索特发性肺纤维化相关数据集,以样本量大于20,同时包含正常样本和疾病样本作为筛选条件,并对数据集进行质量控制和主成分分析,保证得到的数据集可用于差异分析。随后使用R软件对筛选得到的数据集进行归一化处理及差异分析,以|log 2 FC| ≥1,adj. P <0.05为筛选标准得到差异表达基因(DEGs)。从FerrD数据库(http://www.zhounan.org/ferrdb/current/)获取铁死亡基因(FRGs)。利用韦恩图对DEGs和FRGs取交集得到铁死亡相关DEGs。
1.2蛋白质相互作用网络(PPI)构建及核心基因筛选
将铁死亡相关DEGs基因导入STRING平台(https://cn.string-db.org/),设置对比物种为“homo sapines”,选择置信度为0.4,进行PPI分析,并通过Cytoscape软件中的hubba插件筛选基因并可视化,hubba插件中的MCC算法被认为是更科学的算法,将MCC得分前5的基因作为核心基因。
1.3基因集富集分析(GSEA)
为进一步探索核心基因在特发性肺纤维化中的相关信号通路,使用GSEA软件(4.2.3)进行GSEA富集分析,以核心基因表达量的中位数将特发性肺纤维化组分为基因高表达组和低表达组,在分子特征数据库(http://www.gsea-msigdb.org/gsea/msigdb/index.jsp)下载“c2.cp.kegg.v7.5.1.symbols.gmt”数据集作为背景,采用默认加权富集法,随机组合设置为1 000次,以adj. P <0.05,|NES|>1,FDR<0.25作为筛选条件筛选显著富集的信号通路。
1.4潜在的具有治疗作用的中药及成分预测
通过Coremine数据库(https://coremine.com/medical/#search)搜集核心基因对应的中药,以核心基因共有中药且Significance<0.05作为目标中药导入中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php),以药动学参数口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件 [ 9-10],筛选出核心中药并收集其活性成分,运用Cytoscape(3.9.0)Version软件,构建核心中药-活性成分网络图,筛选出核心活性成分。
1.5核心基因与核心活性成分分子对接验证
利用PDB数据库(https://www.rcsb.org)下载核心基因靶点已验证的3D晶体结构,使用Pymol软件进行去水加氢等预处理。从TCMSP中下载核心活性成分的MOL2格式文件,再使用Autodock Vina软件将核心活性成分和核心基因靶点进行分子对接,以结合能大小作为判断成分与基因靶点是否能够结合的指标,最后使用Pymol软件对分子对接结果进行可视化处理。
2结果
2.1DEGs和FRGs获得情况
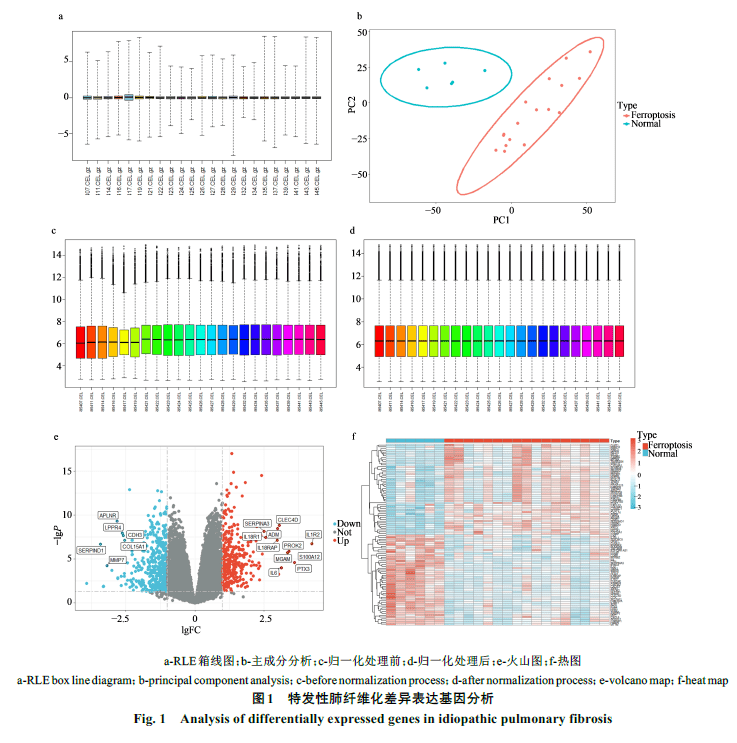
在GEO数据库中筛选得到GSE24206数据集,其包含6例正常肺组织样本和17例特发性肺纤维化肺组织样本。运用R语言对GSE24206数据集进行质量控制,选择其中的RLE箱线图进行展示(图1-a),结果表明:GSE24206数据集芯片间具有较好的一致性,可以用于进行差异基因分析。主成分分析显示特发性肺纤维化组和正常对照组,组内距离较近,组间距离较远,两组样本间无明显交集,有较好的可比较性(图1-b)。同时为去除各样本间批次效应,进行差异分析前对数据集进行归一化处理(图1-c为归一化处理前,图1-d为归一化处理后)。最终差异分析共获得723个DEGs,其中308个上调基因,415个下调基因,并绘制火山图(图1-e)和热图(图1-f)。在FerrDb数据库中共获得487个FRGs。
2.2特发性肺纤维化差异表达和铁死亡共同靶点PPI和及核心基因分析
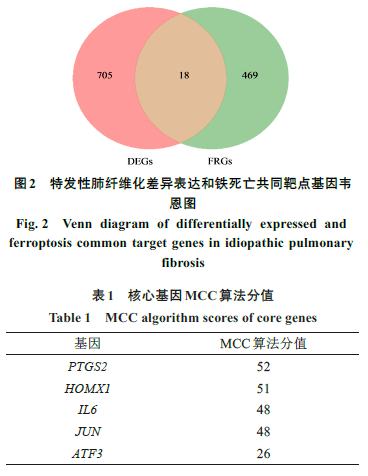
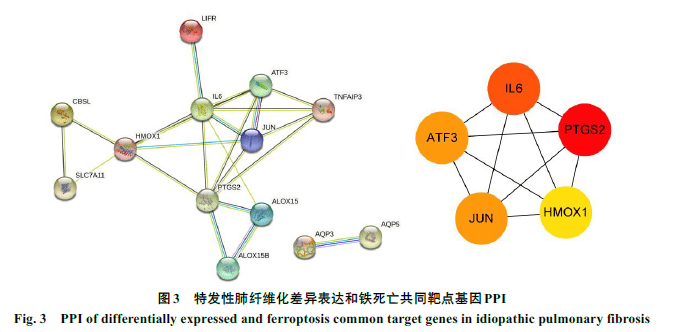
利用韦恩图对DEGs和FRGs取交集,共得到18个铁死亡相关的DEGs,分别为溶质载体家族7成员11(SLC7A11)、驱动家族成员20A(KIF20A)、长链脂肪酸辅酶A链接酶1(ACSL1)、前动力蛋白2(PROK2)、胱硫醚-β-合成酶(CBS)、白血病抑制因子受体(LIFR)、花生四烯酸-15-脂加氧酶(ALOX15)、白细胞介素6(IL6)、水通道蛋白3(AQP3)、转录激活因子3(ATF3)、水通道蛋白5(AQP5)、4次跨膜蛋白A15(MS4A15)、转录因子AP-1(JUN)、人金属硫蛋白1G(MT1G)、环加氧酶2(PTGS2)、花生四烯酸-15-脂加氧酶B(ALOX15B)、肿瘤坏死因子α引导蛋白3(TNFAIP3)和血红素加氧酶1(HMOX1)。韦恩图见图2。将18个铁死亡相关DEGs导入String平台构建PPI网络,通过Cytoscape 软件中的hubba插件“MCC”算法确定5个核心基因,分别为PTGS2、HOMX1、IL6、JUN和ATF3,其中PTGS2的分值最高(见表1)。可视化结果见图3。
2.3GSEA富集分析
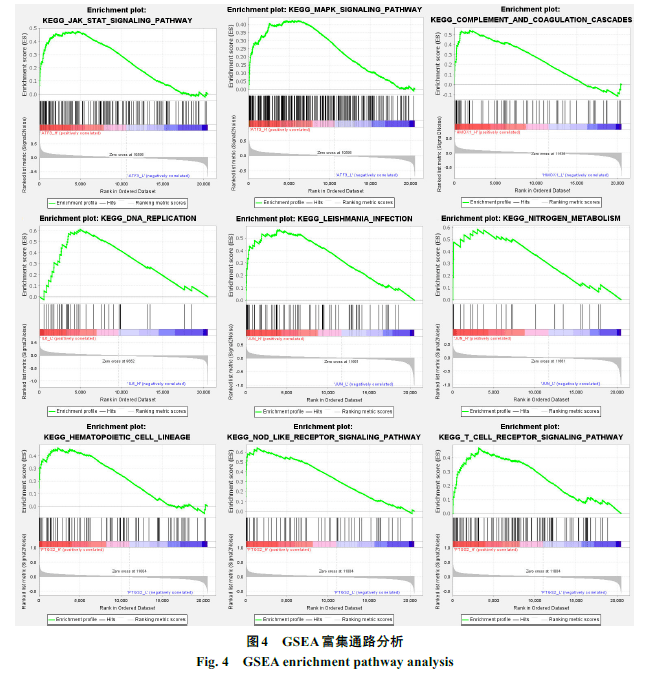
GSEA分析结果显示,核心基因高表达显著富集的通路有:结节样受体信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、信号转导子和转录激活子(JAK/STAT)信号通路、T细胞受体信号通路及Toll样受体信号通路等。其中结节样受体信号通路、MAPK信号通路和JAK/STAT信号通路在4个核心基因高表达中均显著富集。部分结果展示见图4。
2.4潜在治疗中药及成分预测
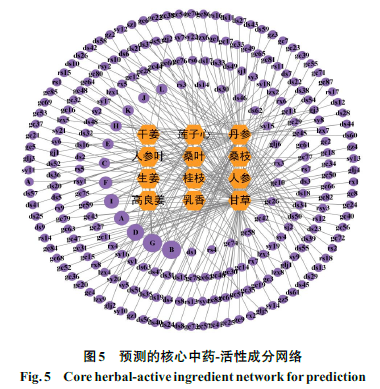
将核心基因PTGS2、HOMX1、IL6、JUN和ATF3导入Coremine数据库,查找对应中药,规范中药名后进行整理,共得到134种中药,其中5种基因共有中药17种,将17种中药导入TCMSP数据库,以OB≥30%和DL≥0.18为条件搜集活性成分,去除无活性成分的中药,共得到12种中药(丹参、干姜、莲子心、人参叶、桑叶、桑枝、生姜、桂枝、人参、高良姜、乳香、甘草)和242种活性成分,运用Cytoscape(3.9.0)Version软件,构建核心中药-活性成分网络图(图5);其中六边形为核心中药,圆形为中药活性成分,活性成分度值越大则图形越大,度值排名前4位的确定为核心活性成分,分别为槲皮素、山柰酚、谷甾醇和β-谷甾醇。部分活性成分相关信息见表2。

2.5分子对接验证结果
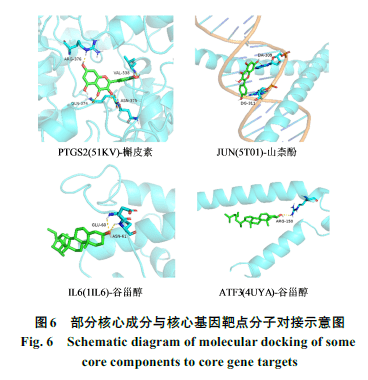
将核心活性成分与核心基因靶点进行分子对接验证。结果显示结合能均<0(表3)。一般认为化合物和靶点结合能<0提示两者可自发结合,结合能越低,配体和受体结合的构象越稳定,发生作用的可能性越大,一般认为结合能<-20.92 kJ·mol-1表示有良好结合活性。最后使用PyMol软件对分子对接结果进行可视化,并选取部分对接结果进行展示(图6)。
3讨论
特发性肺纤维化是特发性间质性肺炎中最常见的且预后极差的疾病,其临床病程具有高度异质性和不可预测性,大多数患者的临床症状、肺功能情况及影像学表现恶化相对较慢,但少数患者会出现呼吸系统急性恶化,且死亡率高达40%[11]。近年来随着空气污染加重等原因,特发性肺纤维化发病率不断增加,并随之带来沉重的卫生经济负担,而临床治疗手段却非常有限。因此挖掘特发性肺纤维化潜在治疗靶点和有效治疗药物意义重大。已有相关研究表明中药及中药成分在治疗特发性肺纤维化上具有一定疗效 [ 12-15],但作用机制尚不明确。通过明确铁死亡与特发性肺纤维化的共同表达基因并预测潜在治疗中药及中药成分,可为特发性肺纤维化的治疗药物开发带来新的思路。
本研究通过生物信息学得到可能从铁死亡方向治疗特发性肺纤维化的18个铁死亡DEGs,并通过进一步筛选得到5个核心基因:PTGS2、HOMX1、IL6、JUN和ATF3。其中PTGS2是前列腺素生物合成中的关键酶,既是一种双加氧酶又是一种过氧化物酶。有研究表明,PTGS2可能通过其2个主要产物前列腺素E 2 (PGE 2 )和前列腺素D 2 (PGD 2 )发挥其抗纤维化作用 [ 16]。IL6是由成纤维细胞、单核细胞、B细胞、巨噬细胞、树突状细胞等合成的多方面促炎细胞因子,在慢性炎症、自身免疫和纤维化中发挥重要作用 [ 17-18]。ATF3是一种应激诱导的转录因子,在调节代谢、免疫和癌变中起着至关重要的作用,同时也与肺纤维化密切相关 [ 19]。研究表明吡非尼酮可以通过下调ATF3抑制成纤维细胞向肌成纤维细胞转化 [ 20]。上述结果表明,核心基因PTGS2、HOMX1、IL6、JUN和ATF3可能是从铁死亡方向治疗特发性肺纤维化的潜在靶点。
核心基因进行GSEA通路分析,鉴定出JAK/STAT、MAPK及Toll样受体等信号通路。其中JAK/STAT信号通路可以被大量促纤维化或促炎细胞因子(如IL6、IL11和IL13等)的相互作用下激活,从而促进肺纤维化的发展 [ 21-22],最新研究表明通过阻断IL6的JAK抑制剂可以减轻新型冠状病毒性肺炎的过度炎症反应及肺纤维化 [ 23]。MAPK信号通路也在肺纤维化进展中发挥重要作用,MAPK信号通路第一个确定的成员是细胞外信号调节激酶(ERK),其在特发性肺纤维化中过表达 [ 24],抑制ERK可以阻断上皮-间充质转化(EMT)过程从而减轻博来霉素诱导的PF[25]。另有研究发现MAPK在LiCI和Wnt1诱导的A549细胞EMT中起关键作用,通过SB203580或MAPK siRNA对MAPK信号通路的干扰,可以阻断EMT和纤维蛋白合成,且可以通过转染MAPK表达质粒逆转这一过程 [ 26]。Toll样受体是一系列模式识别受体,通过激活核因子-κB(NF-κB)和干扰素调节因子(IRFs),对脂多糖等微生物抗原做出反应,最终启动促炎基因的表达,在先天免疫中起着至关重要的作用 [ 27- 28]。然而,虽然Toll样信号通路对病原体的清除至关重要,但其信号传导不足或过度会对宿主造成伤害,导致慢性炎症疾病的发生,从而促进纤维化的发生发展 [ 29]。上述GSEA结果表明,可能通过调节JAK/STAT、MAPK及Toll样受体等信号通路调节铁死亡从而干预特发性肺纤维化的进展。
通过Coremine数据库和TCMSP数据库预测得到丹参、干姜、人参、生姜、人参叶、桑叶、桑枝、桂枝、乳香、莲子心、高良姜和甘草12种中药,以及4种关键活性成分槲皮素、山柰酚、谷甾醇和β-谷甾醇。相关研究表明人参活性成分通过多种途径延缓肺纤维化的进展。人参皂苷元AD-1可显著抑制脂多糖诱导的成纤维细胞增殖与迁移 [ 30]。人参皂苷R1同样具有延缓肺纤维化的作用,其机制可能通过抑制过氧化氢诱导的人胚胎细胞MRC-5细胞PI3K/Akt通路蛋白的磷酸化,抑制细胞增殖,减少胶原沉淀,提高细胞的抗氧化能力 [ 31]。丹参及其活性成分丹参酮II A 在治疗肺纤维化方面已被广泛研究;可以抑制JAK2-STAT3/STAT1信号通路诱导的成纤维细胞的活化和迁移,发挥抗炎和纤维化的作用,从而缓解特发性肺纤维化的进展 [ 32];丹酚酸B通过抑制炎性细胞浸润、肺泡结构破坏和胶原蛋白沉积,发挥明显的抗炎和抗纤维化作用,其可以通过抑制Smad依赖性信号通路和非Smad依赖性的MAPK信号通路,抑制TGF-β诱导的肌成纤维细胞分化和TGF-β介导的A549细胞的EMT[33];此外,隐丹参酮可通过抑制脂多糖诱导后肺组织中的内皮间质转化过程从而延缓急性呼吸窘迫综合征小鼠早期肺纤维化 [ 34]。莲子心为临床常用中药之一,其有效成分异莲心碱对半乳糖所致的肺纤维化氧化损伤有保护作用 [ 35]。莲子心提取物可通过抑制胶原纤维合成、抗氧化、下调α-SMA的表达以此减少细胞外基质的沉积,并降低TGF-β1的表达抑制成纤细胞的活化、增殖,从而起到抗纤维化作用 [ 36]。关键活性成分β-谷甾醇为6种中药的共有成分,为本研究预测最有可能的潜在治疗成分之一,有相关研究显示β-谷甾醇可抑制肺组织细胞凋亡,降低炎症反应,并减轻肺纤维化 [ 37]。Park等 [ 38]发现β-谷甾醇能通过抑制TGF-β1/Snail途径抑制EMT过程来减轻肺纤维化。另一关键成分槲皮素通过抑制TGF-β1对人肺腺癌细胞株A549细胞诱导的EMT的转变,减轻肺纤维化大鼠的炎症反应,缓解博来霉素所致大鼠肺纤维化,还可通过抑制NOX4-P62信号途径,激活自噬,减轻大鼠肺纤维化 [ 39-40]。
本研究以铁死亡为切入点,运用生物信息学分析特发性肺纤维化的潜在治疗靶点、作用机制以及潜在治疗中药及成分,预测得到丹参、人参、莲子心、桂枝等12种中药和槲皮素、β-谷甾醇、山柰酚、谷甾醇4种活性成分,这些药物可通过作用于PTGS2、HOMX1、IL6、JUN和ATF3治疗靶点,参与结节样受体、MAPK和JAK/STAT等相关信号通路,起到调节铁死亡治疗特发性肺纤维化的作用。为治疗特发性肺纤维化的新药研发及中药单体研发提供思路及理论依据,为特发性肺纤维化的临床治疗和后续实验研究提供新方向。本研究基于理论层面预测通过调节铁死亡方式干预特发性肺纤维化的可能治疗靶点、中药及成分,具有一定局限性,后期将行进一步的实验研究对结果进行验证。
利益冲突所有作者均声明不存在利益冲突
参考文献(略)
来 源:李永顺,谢嘉嘉,李航,张立,欧阳子琛,徐铭芝,雷雅涵.基于生物信息学及铁死亡分析特发性肺纤维化的差异基因及潜在的治疗中药预测 [J]. 药物评价研究, 2023, 46(3): 501-509
- 本文固定链接: https://www.maimengkong.com/kyjc/1610.html
- 转载请注明: : 萌小白 2023年8月18日 于 卖萌控的博客 发表
- 百度已收录
