1. 超级增强子介绍
超级增强子的概念于2013年由美国学者Richard A. Young及其团队首次提出。与调控范围通常在200-300个碱基对(bp)的普通增强子相比,超级增强子的显著特征在于其巨大的基因组跨度,通常可达8至20千碱基对(kb)甚至更长。 超级增强子区域结合多种转录因子,调控转录状态。
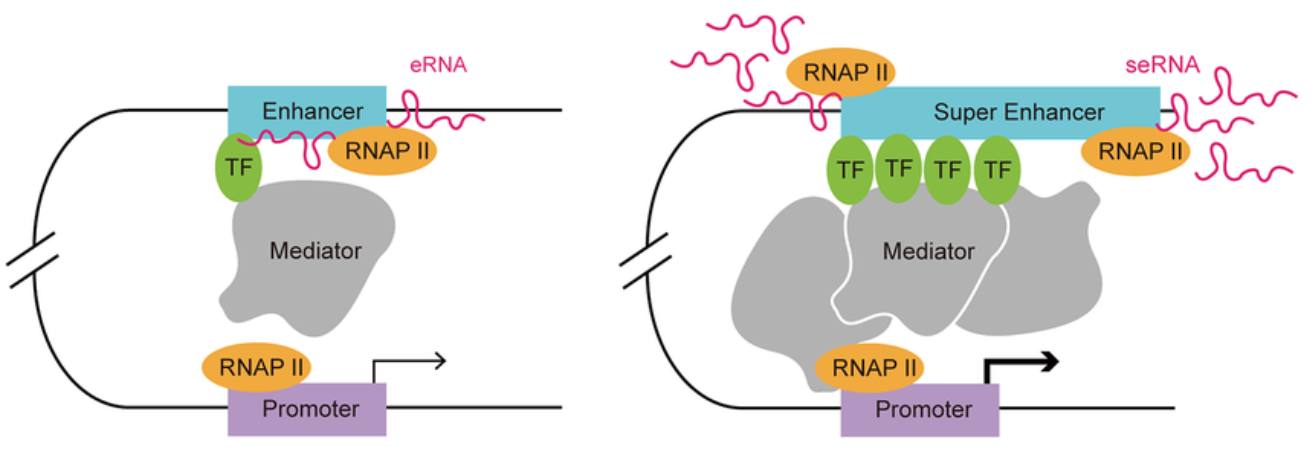
1.1 定义与发现
发现历程:从普通增强子到超级增强子
超级增强子的发现源于对胚胎干细胞(ESCs)中关键基因调控机制的深入研究。在2013年发表于《Cell》杂志的两篇开创性论文中,Young团队系统地分析了小鼠胚胎干细胞中多种主转录因子(如Oct4, Sox2, Nanog)和关键共激活因子(如Mediator复合物的Med1亚基)的基因组结合位点。通过全基因组染色质免疫沉淀测序(ChIP-seq)技术,他们发现这些调控因子的结合位点在某些关键细胞身份基因附近呈现出异常密集的聚集现象。
1.2 超级增强子 vs. 普通增强子
1.2.1 结构差异
在小鼠胚胎干细胞中,典型增强子的中位长度约为703 bp,而超级增强子的中位长度则达到了8.7 kb,是普通增强子的十倍以上。这种结构差异反映了调控元件在三维空间上的高度组织化。
1.2.2 功能差异
与超级增强子相关联的基因,其表达水平通常显著高于由普通增强子调控的基因。这种超强的激活能力源于其独特的结构和分子组成。
1.2.3 分子特征对比
分子特征 | 普通增强子 (TE) | 超级增强子 (SE) |
|---|---|---|
组蛋白修饰 | H3K4me1 (高), H3K27ac (中) | H3K4me1 (高), H3K27ac (极高) |
转录共激活因子 | 少量结合 (如p300, CBP) | 大量富集 (如p300, CBP, BRD4) |
Mediator复合物 | 少量结合 | 高度富集 (如Med1, Med12) |
转录因子 (TFs) | 结合少量TFs | 结合大量主转录因子 |
RNA聚合酶II | 可能存在 | 高度富集,并产生活跃的eRNA |
1.3 生物学功能与意义
1.3.1 决定细胞身份与命运
超级增强子在决定和维持细胞身份方面扮演着至关重要的角色。它们通常与那些定义细胞类型和功能的关键基因(即细胞身份基因)紧密关联。例如,在胚胎干细胞中,与多能性维持相关的基因(如Oct4, Sox2, Nanog)附近就存在着强大的超级增强子。
1.3.2 驱动关键基因表达
超级增强子驱动的基因表达水平通常比普通增强子驱动的基因高出数倍甚至数十倍。这种高效的调控机制确保了细胞在特定生理或病理条件下能够快速、足量地产生所需的关键蛋白质。
1.3.3 与疾病的关联
越来越多的证据表明,超级增强子的异常与多种人类疾病,特别是癌症的发生发展密切相关。在肿瘤细胞中,基因组的重排、扩增或突变等事件可能导致新的超级增强子在原癌基因附近形成,驱动原癌基因的过量表达。
2. 超级增强子的鉴定方法
超级增强子的鉴定主要依赖于染色质免疫沉淀测序(ChIP-seq)或更灵敏的CUT&Tag技术,通过检测H3K27ac等标志物的富集信号,并利用ROSE算法等生物信息学工具进行识别和分析。
2.1 实验技术
2.1.1 ChIP-seq技术
染色质免疫共沉淀测序是目前鉴定超级增强子最常用和最经典的技术手段。利用抗体特异性地"捕获"与特定蛋白质结合的DNA片段,在全基因组范围内定位蛋白质结合位点。
关键步骤
细胞交联(Cross-linking)
染色质片段化(Chromatin Shearing)
免疫沉淀(Immunoprecipitation)
解交联和DNA纯化
文库构建和高通量测序
2.1.2 CUT&Tag技术
CUT&Tag(Cleavage Under Targets and Tagmentation)是一种新兴技术,巧妙结合了抗体靶向和Tn5转座酶的活性,无需甲醛交联和免疫沉淀等繁琐步骤。
优势特点
极高灵敏度:可低至几十个细胞
高信噪比:避免非特异性结合
实验周期短:一天内完成
操作简单:降低技术门槛
技术对比
特性 | ChIP-seq | CUT&Tag |
|---|---|---|
原理 | 染色质免疫沉淀 + 测序 | 靶向切割与标签化 + 测序 |
样本起始量 | 高 (通常 ≥ 10⁷ 细胞) | 极低 (可低至 2×10⁵ 细胞) |
是否需要交联 | 是 | 否 |
实验周期 | 长 (2-3天) | 短 (1天) |
信噪比 | 中等 | 高 |
2.2 关键指标
H3K27ac:活性增强子的标志
H3K27ac(组蛋白H3第27位赖氨酸的乙酰化)被广泛认为是活性增强子最可靠的标志物之一。超级增强子由于其强大的转录激活能力,其区域内会聚集大量的转录因子和辅因子,导致H3K27ac的修饰水平远高于普通增强子,表现为更宽、更高的信号峰。
Mediator蛋白结合:转录机器的"桥梁"
Mediator复合物是连接转录因子和RNA聚合酶II的关键桥梁。在超级增强子区域,由于聚集了大量的细胞类型特异性转录因子,Mediator复合物也会被大量招募至此。[在最初的超级增强子研究中,Richard A. Young实验室正是通过分析Med1的ChIP-seq信号,首次定义了超级增强子这一概念。
2.3 数据分析方法
ROSE算法
ROSE(Rank Ordering of Super-Enhancers)算法是目前鉴定超级增强子最主流、最权威的生物信息学工具,由Richard A. Young实验室开发。其核心思想是基于一个关键观察:增强子调控元件的信号强度分布是不均匀的,存在一小部分增强子,其信号强度远高于其他大部分增强子。
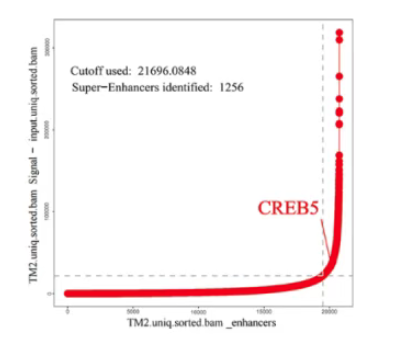
算法将所有增强子按信号强度从低到高排序,绘制强度-排名曲线。曲线上的拐点将普通增强子与超级增强子分开。
3. 总结与展望
超级增强子作为近年来基因调控领域的研究热点,正在逐步揭开细胞命运决定与疾病发生发展的“黑匣子”。它们不仅为我们理解生命活动的基本规律提供了新的视角,也为肿瘤学、再生医学以及药物研发等方向带来了潜在的应用价值。随着单细胞组学、空间组学和人工智能算法的发展,未来我们将能够更精确地绘制超级增强子网络图谱,甚至有望通过靶向超级增强子实现疾病的精准干预。