确保外源基因在细胞或者动物体内,持续和高水平的表达具有广泛的应用需求及科研价值。当前递送外源基因的生物学手段,主要是运用质粒或者病毒作为媒介表达基因,而启动子是实现基因表达的基础元件。但是,经常有老师反馈,为什么基因表达不强呢?为什么细胞传代几次之后就不表达了呢?今天,小编带您盘点下,常用的组成型启动子表达效率与细胞的关系。
启动子是位于结构基因上游的一段可以行使转录起始功能的序列,结构如下:
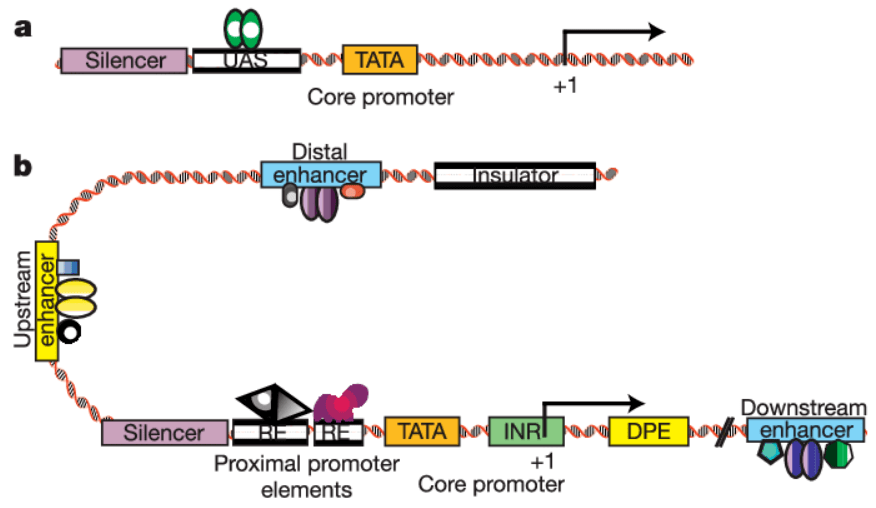
根据其对α-鹅膏蕈碱的敏感性不同,分为三类,常用的启动子是Ⅱ、Ⅲ两种启动子。其中,Ⅲ型启动子主要表达非编码的短序列RNA,比如shRNA、miRNA等,我们常说的启动子,或者细胞里面常规基因的启动子,几乎都是Ⅱ型启动子,其特点是转录产物长度不限,编码与否不限等特点。
酶的种类1
存在
功能
对抑制物的敏感性
RNA聚合酶I
核仁
合成rRNA前体
不敏感
RNA聚合酶II
核质
合成mRNA前体及大多数snRNA
敏感
RNA聚合酶III
核质
合成5S rRNA前体、tRNA前体及其他的核和胞质小RNA前体
存在物种特异性
Ⅱ型启动子在使用特点上又可分为三大类:组成型启动子、特异性启动子、诱导启动子。特异性启动子只能在特定细胞表达,因此适合动物实验使用;诱导启动子需要加入特定的药物才能激发或者抑制其活性,如四环素诱导TRE表达;而表达系统中,运用最多的则是组成型启动子,这类启动子在绝大部分细胞里面都能维持一定的表达活性,当然,不同的启动子也有高低表达之分。
载体上最常见的组成型启动子包含:β-肌动蛋白启动子(ACTB),巨细胞病毒(CMV),延伸因子-1α(EF1α),磷酸甘油酸激酶(PGK)、泛素C(UbC、本文别名FCIV),具有CMV最大内含子的CMV启动子/增强子(CMVi启动子)、巨细胞病毒增强子和鸡β-肌动蛋白启动子组成的CAG,猿猴病毒来源的SV40等。其中,最常见的是CMV启动子,在大量的商业化载体上如pcDNA3、pEGFP使用,病毒上最常见启动子是CMV、EF1α,说明这些都是高表达启动子,那么所有细胞系都合适吗?小编收罗了不同文献、不同细胞类型的验证实验,接着往下看:
混合细胞系
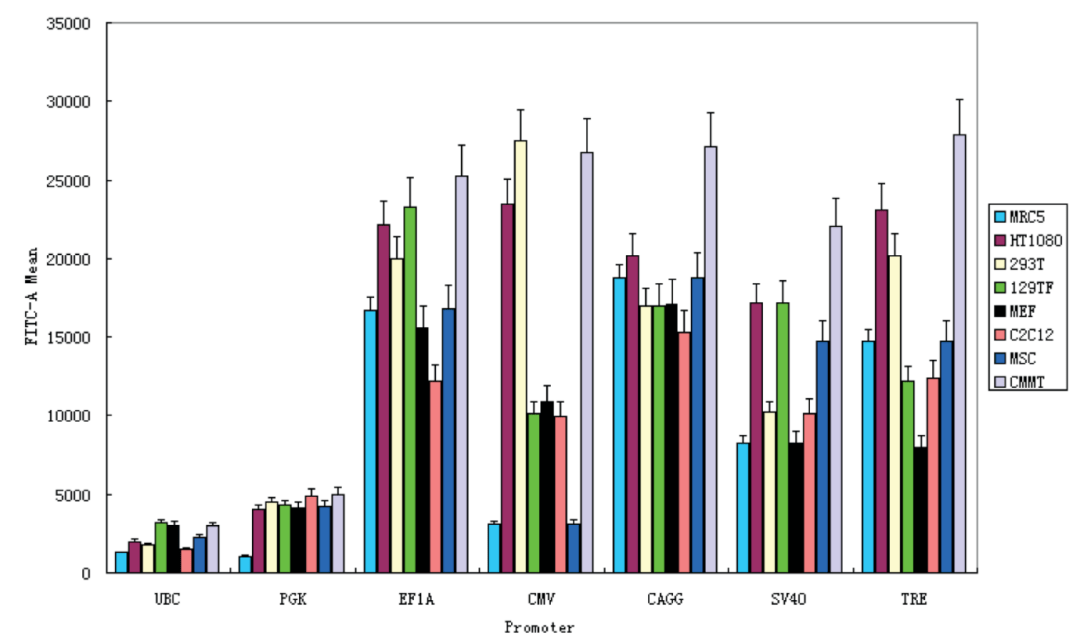
作者选了多种来源的细胞,包含成纤维细胞、肿瘤细胞、干细胞、高度分化的肌肉细胞等,使用六个哺乳动物组成型启动子,每个都插入GFP包装成慢病毒转导细胞,通过流式细胞仪对GFP强度进行定量:
小鼠尾巴成纤维细胞(129TF),小鼠胚胎成纤维细胞(MEF),小鼠成肌细胞(C2C12),大鼠间充质干细胞(MSC),人成纤维细胞(MRC5),人纤维肉瘤细胞(HT1080),人胚胎肾细胞(293T)和恒河猴猕猴乳腺肿瘤细胞(CMMT)
结果表明:UBC跟PGK始终是弱的,SV40相对较强,EF1A和CAG启动子在所有细胞类型中均具有较强的一致性,CMV启动子是最多变的,是在一些细胞类型(很强烈例如,293T和CMMT)和其他(较弱例如,MRC5和MSC)。
由此看出,CMV在肿瘤细胞系倾向高表达,而EF1A和CAG在大部分细胞表达趋于稳定,且这三个高强度启动子在干细胞等类型活性都有所下降。所以,针对常规的肿瘤细胞系,常规体细胞系,三个启动子的效果还是不错的,但由干细胞表达效果差,推导出非常规的细胞系,如悬浮细胞系、神经细胞等,启动子如何选择呢?
胚胎干细胞(hESCs)
干细胞相对复杂,因为还存在分化过程的干细胞,那么干细胞对于启动子的选择有何特点呢?
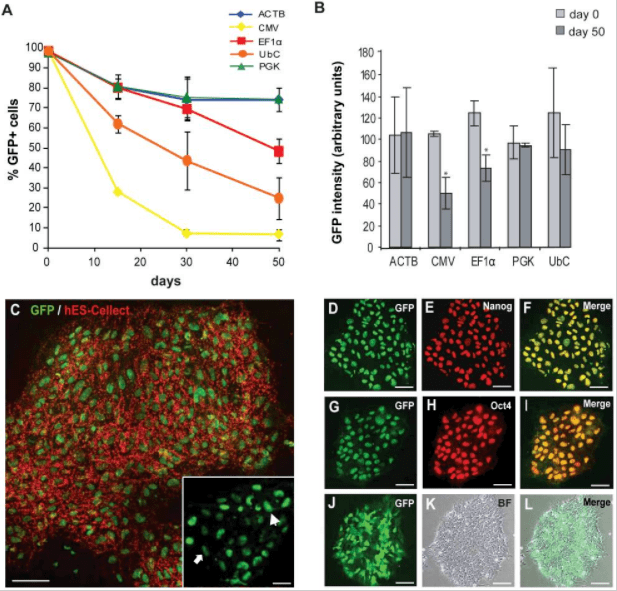
对hESCs中ACTB,CMV,EF1α,PGK和UbC启动子的活性进行了比较研究。选择慢病毒介导的基因转移作为基因传递系统,通过FACS分选出了eGFP +细胞,结果如下:
1.未分化的hESCs的启动子活性
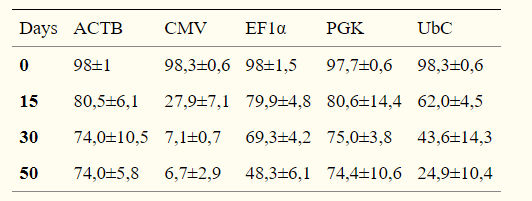
在FACS分选后的15、30和50天测量启动子活性,通过OCT3 / 4,NANOG和hES-Cellect(Cellartis AB)多能蛋白的标记证实了eGFP +细胞的多能性:
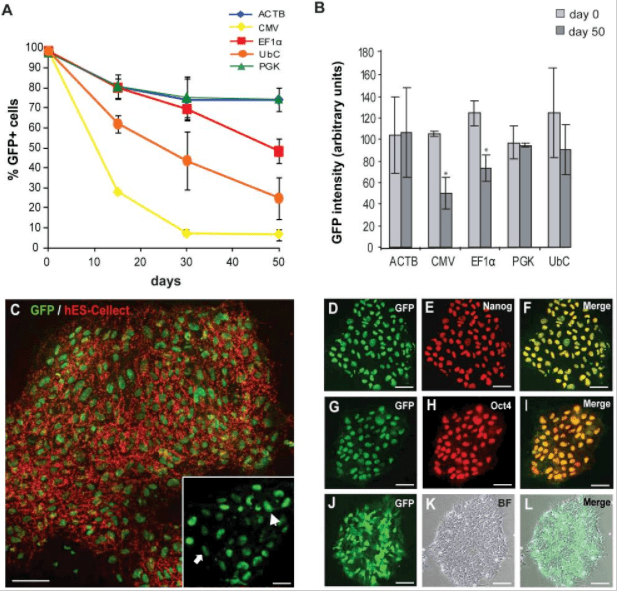
第0天,所有启动子的eGFP+百分比约为98%,第30天,ACTB,EF1α和PGK的启动子活性均相等,第50天,CMV-eGFP+细胞的百分比降低于10%,EF1α也出现下降。
2. 分化的hESCs中的启动子活性
慢病毒介导GFP的将hESC系SA121,在第0天(d0),未分化状态第22天(undiff),分化为胚状体22天(EB),测试GFP +细胞的比例,结果显示,启动子在分化过程中被显著下调,并且在大约50%的分化细胞中没有活性。EF1α是分化过程中最稳定的启动子;CMV启动子仅在细胞的一小部分(约15%)具有活性。
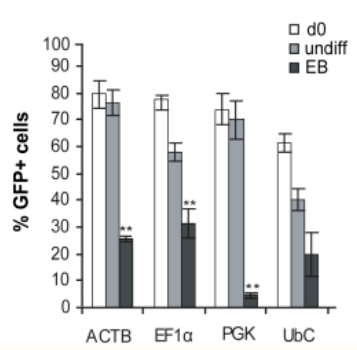
总之,就长期保持未分化的hESCs的转基因(eGFP)表达而言,ACTB,EF1α和PGK启动子是最稳定的启动子;而在分化过程中,成型启动子的活性会下降,相对而言,EF1α启动子具有最高的稳定性。原因即细胞在分化过程中,所表达的转录因子是有差异的,部分启动子表达所需的转录因子丢失,同时染色体结构的改变影响了外源插入序列的状态,导致启动子出现沉默现象。
造血干细胞(HSC)/祖细胞
造血干细胞(HSC)具有自我更新和多谱系分化成所有成熟血细胞的潜力。因此,有效转导至HSCs将提供治疗因血细胞功能异常而导致的多种疾病的机会,并且将成为研究HSCs增殖,分化和运输调节的有力工具。作者构建了携带多个启动子表达荧光的腺病毒,感染两种状态的造血细胞,以流式检测:
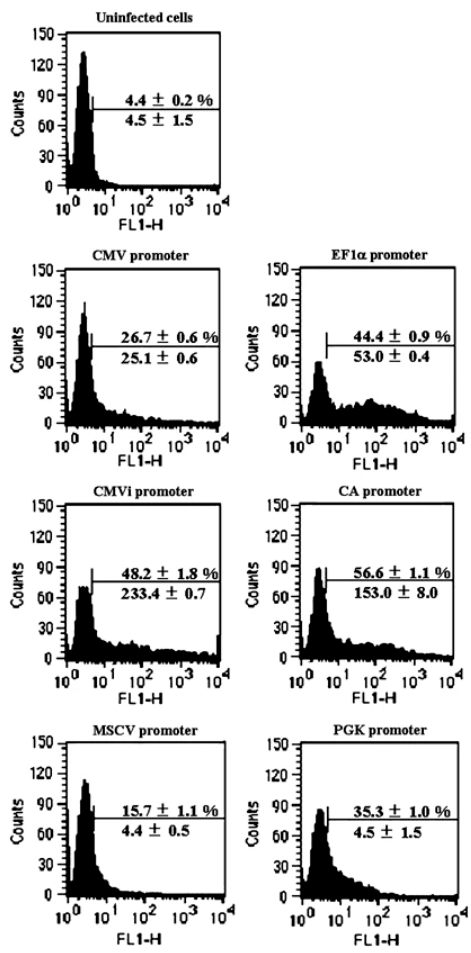
成熟CD34+ 成熟CD34+
免疫细胞
结果显示:当用于造血细胞中时,CMV启动子倾向于沉默。转基因可能以非常低的水平表达或无法检测。EF1α、CMVi和CAG启动子在转导人骨髓CD34+细胞方面表现优异。特别地,CAG启动子在CD34+细胞和未成熟的CD34+亚群中最有效地发挥作用。
当前,以CAR-T和TCR-T为代表的细胞治疗非常火热,前者都需要运用慢病毒感染T细胞。免疫类细胞,诸如T细胞,病毒感染难度较大,启动子的选择得注意。
作者构建多个启动子的慢病毒载体表达荧光,感染经过IL-2刺激过的PBL细胞,以FACS检测,观察到CMV启动子在原代T细胞驱动效率低,CAG也相对较差,其余几个启动子的效率相近,都在60%上下。
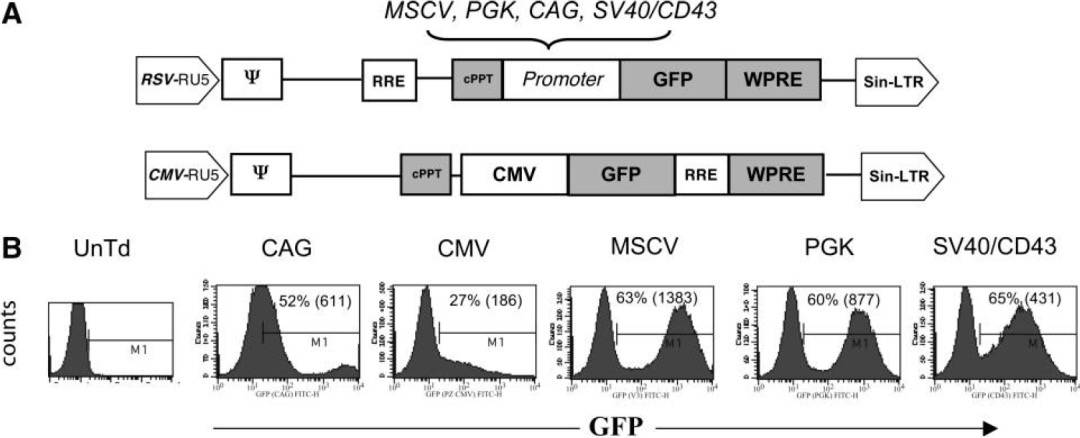
进一步以以抗CD3抗体OKT3刺激细胞,再进行实验,活化后的T细胞,多个启动子的表达效率得到增强,其中以MSCV启动子最优。
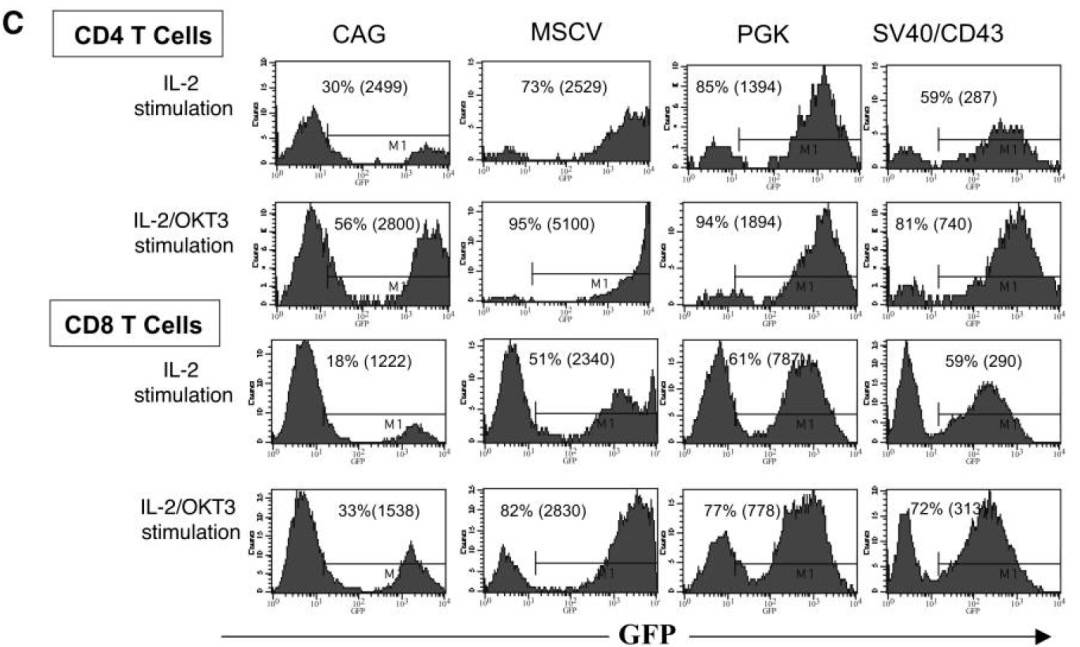
在PBL中,发现含有MSCV启动子的载体最适合,在最低程度刺激的淋巴细胞和高度活化的淋巴细胞中的表达。当然,文章没有比较EF1α,实际后者在T细胞也有不俗的表达水平。
神经细胞
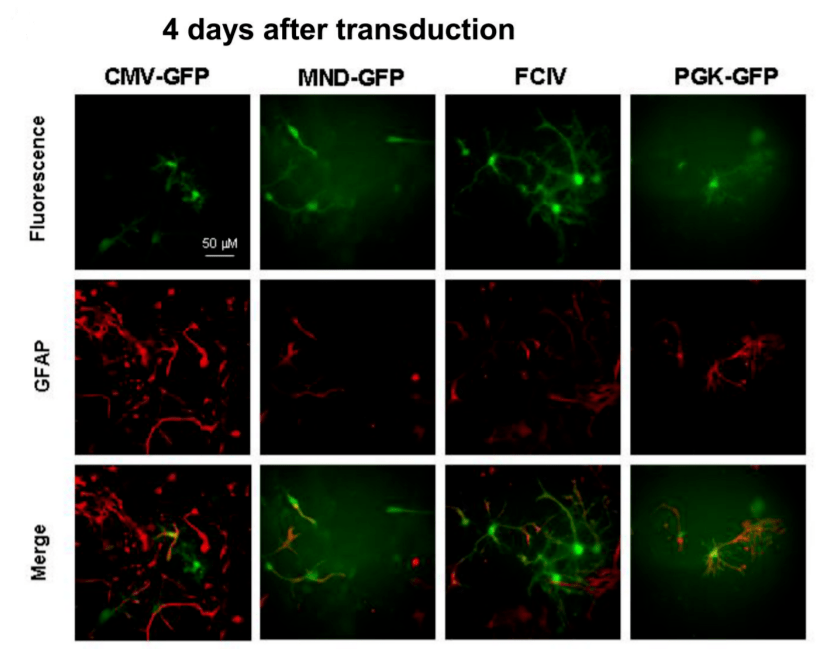
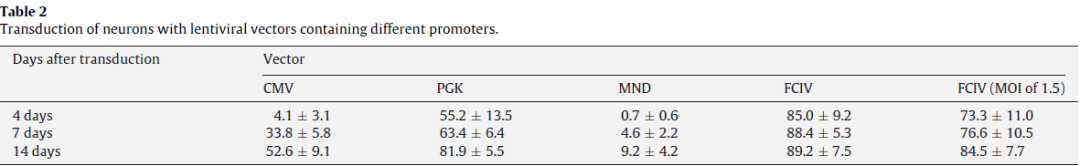
用CMV-GFP,PGK-GFP,MND-GFP和泛素C启动子(FCIV)转导了含有神经元和星形胶质细胞的小鼠新皮层培养物。转导后四天,我们对神经元(NeuN阳性)进行检测,在FCIV转导的培养物中85%的神经元表达了GFP,PGK为55.2%,且大多数报告基因阳性细胞与NeuN共定位;而CMV为4.1%、MND为0.7%。且几乎与NeuN染色的细胞不重叠,说明后两者不适合神经元的表达。
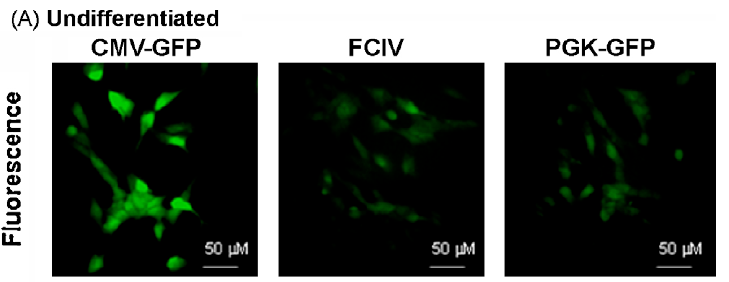
以上述病毒转导来自SH-SY5Y神经母细胞瘤细胞系,结果显示:CMV,PGK和FCIV在未分化和分化的神经母细胞瘤细胞中均具有活性,但CMV启动子活性最高,尤其是在分化后(小脑颗粒神经元显示出相同的结果,数据见原文)。
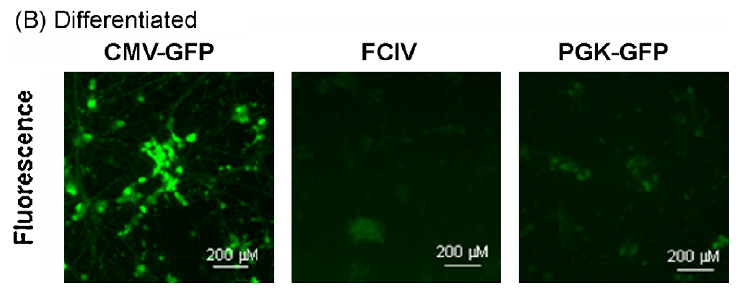
对于涉及原代皮层神经元培养的研究,UBC和PGK启动子可能是基因表达的最佳选择。UBC,PGK,CMV和MND启动子均适用于转导原代星形胶质细胞。在小脑颗粒细胞和分化的SH-SY5Y神经母细胞瘤培养物中,CMV启动子指导最稳定的转基因表达。
总结
通过本文一系列细胞及使用启动子的使用情况的整理,我们可以得出如下结论:
1.CMV启动子作为最为广泛使用的启动子,适合在肿瘤细胞、肌肉、肝脏等体细胞或者贴壁细胞的表达,而不适合大多数干细胞、悬浮细胞及原代细胞的表达;
2.EF1α启动子适合干细胞、原代细胞、造血细胞等的表达,在常用细胞如HEK293、肿瘤等细胞系中弱与CMV;
3.部分细胞在传代过程中,外源启动子会出现沉默现象,不同的启动子沉默效率有所差异,对于少见的细胞系,或者会分化的细胞系,研究者需要考虑启动子的选择,或者多做些分组;
4.CAG启动子在不少细胞系,诸如免疫细胞、体细胞,有不次于CMV的表达效率,也是基因表达的一个较优选择的启动子。
实际上,常用于表达外源基因的启动子主语局限于CMV、EF1α、CAG、UBC等,本文涉及的PGK、SV40等主要用于表达荧光、抗性等,很多载体出现荧光弱等问题,可以看看表达荧光用的何种启动子。当然,诸如悬浮细胞还可以使用SFFV等启动子实现高表达(可参考吉凯基因悬浮病毒载体使用手册)。总之,启动子的选择对于基因的表达至关重要,吉凯也开发了更加高效表达的启动子系列,对于基因表达弱,荧光弱的老师们,快来吉凯咨询吧!!!
【参考文献】
1.Systematic Comparison of Constitutive Promoters and the Doxycycline-Inducible Promoter
2.Quantitative Comparison of Constitutive Promoters in Human ES cells
3.Optimization of adenovirus serotype 35 vectors for efficient transduction in human hematopoietic progenitors: comparison of promoter activities
4.Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells
5.Lentiviral Vector Design for Optimal T Cell Receptor Gene Expression in the Transduction of Peripheral Blood Lymphocytes and Tumor-Infiltrating Lymphocytes- 本文固定链接: https://www.maimengkong.com/kyjc/1436.html
- 转载请注明: : 萌小白 2023年4月15日 于 卖萌控的博客 发表
- 百度已收录
