今天带给大家的是一篇于2021年1月发表在《Cell》上的高分生信文章,题目是“ A modular master regulator landscape controls cancer tranional identity”。
期刊简介
数据来源 & 思路框架
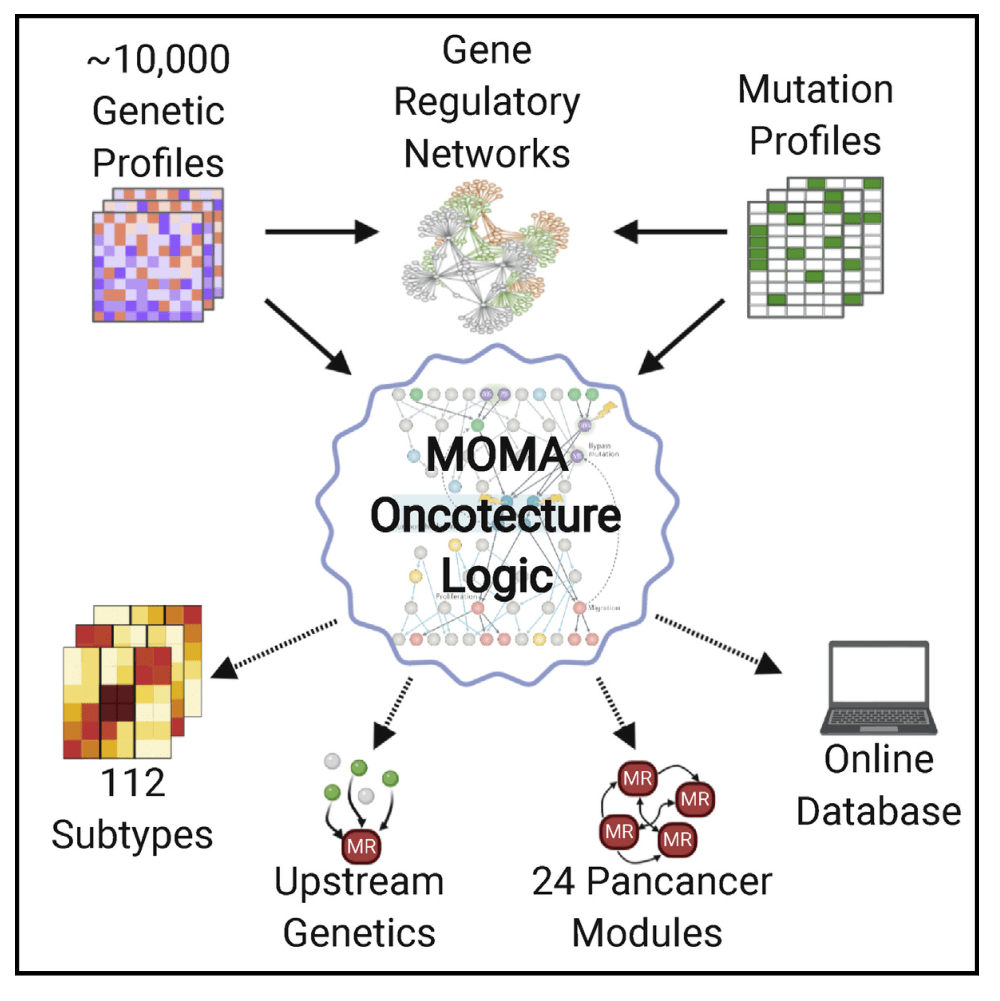
本项研究意在将基因组的改变与癌细胞转录的特性联系起来,探讨其中的机制。那么如何来着手分析呢?这里当然少不了综合性的网络基因组分析。首先,作者将TCGA数据库中20个队列的样本的遗传学基因组数据分析并识别出112个转录不同的肿瘤亚型。由此确定了407种主调节因子(MR)蛋白。进一步将这些MR蛋白进一步组成24个泛癌、主调节阻断模块(MRB),其中每个模块都能够调节关键的癌症特征。并利用临床信息预测多个队列中的患者结局。在每个样本中检测到的所有体细胞改变中,预测>50%会诱发异常MR活动,从而深入了解肿瘤遗传学和转录特性之间的联系机制,并建立非癌基因依赖性。
随后的遗传和药理学验证分析也进一步证实了上游突变和MR活性对下游细胞密度和表型的预测影响。通过以上分析步骤,实现了对突变表达谱的联合分析,确定了不同泛癌亚型,并提供了可测试的假设,从而形成并证实了调节遗传变异效应的机制。
数据精析
阶段一 | 20个TCGA队列的综合基因组分析确定了112个不同的肿瘤亚型
1
查找样本“checkpoints”
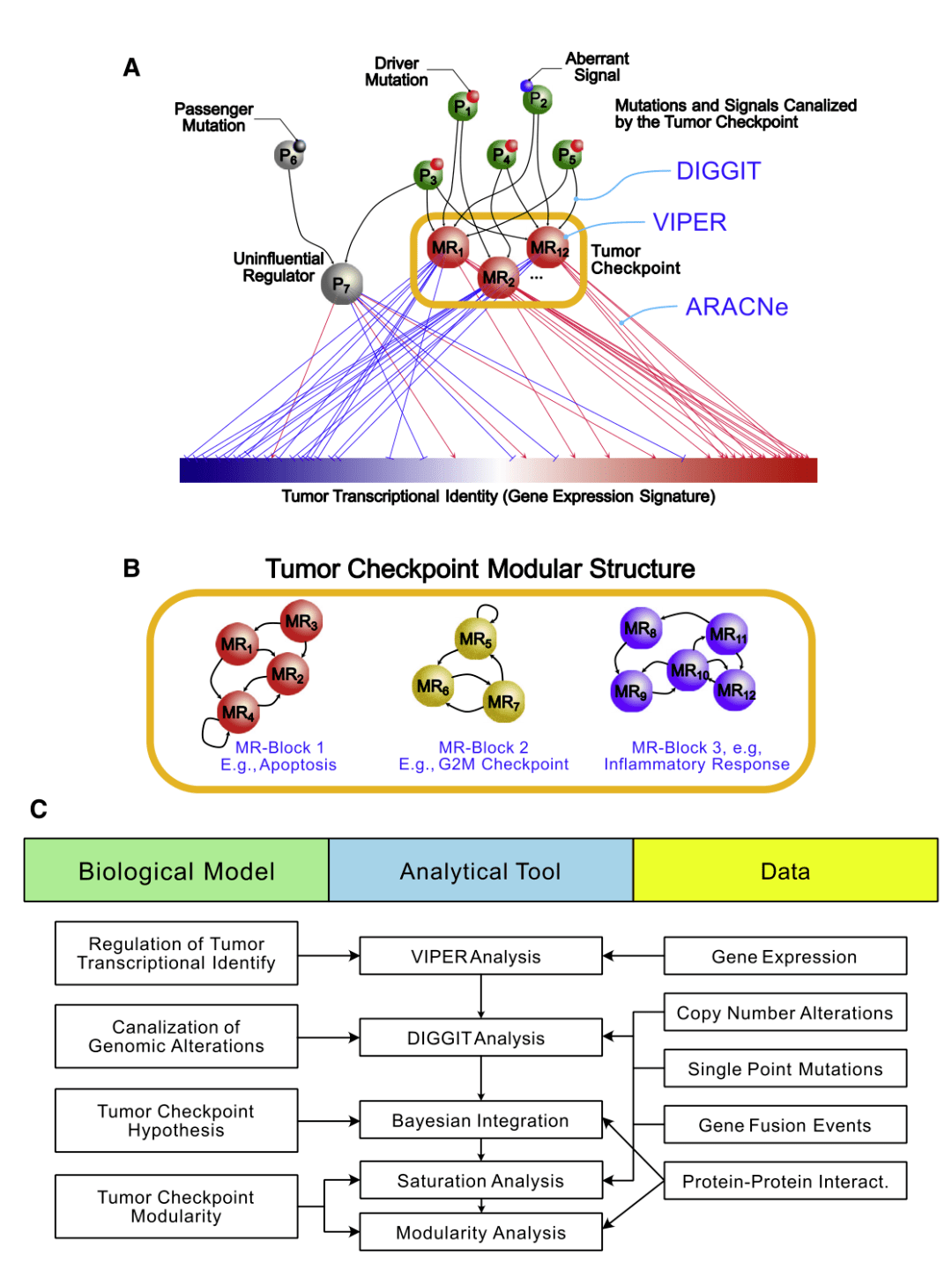
Fig.1
Fig.1A为确定主调节(MR)蛋白的步骤。主调节(MR)蛋白(如MR1-MR12)整合了上游通路蛋白(如P1-P5)中基因组改变(小红球)和异常旁分泌和内分泌信号(小蓝球)的影响。这些MR蛋白通过激活和抑制靶点(分别为红边和蓝边)调节细胞的“下游”转录特性,显示为基因表达特征。其他非MR蛋白改变(小黑球)和不影响细胞转录特性的改变以P6表示,其P7代表不影响MR活性的下游效应物。
这些MR蛋白形成紧密的自动调节模块化结构(肿瘤checkpoints),负责癌细胞转录特性的稳态控制。
Fig.1B展示了肿瘤检查点包括多个子模块结构,称为MR块(MRB),其调节特定的肿瘤标志,并在不同亚型中反复检测。
2
通过基于网络的基因表达和突变谱数据整合鉴定肿瘤亚型
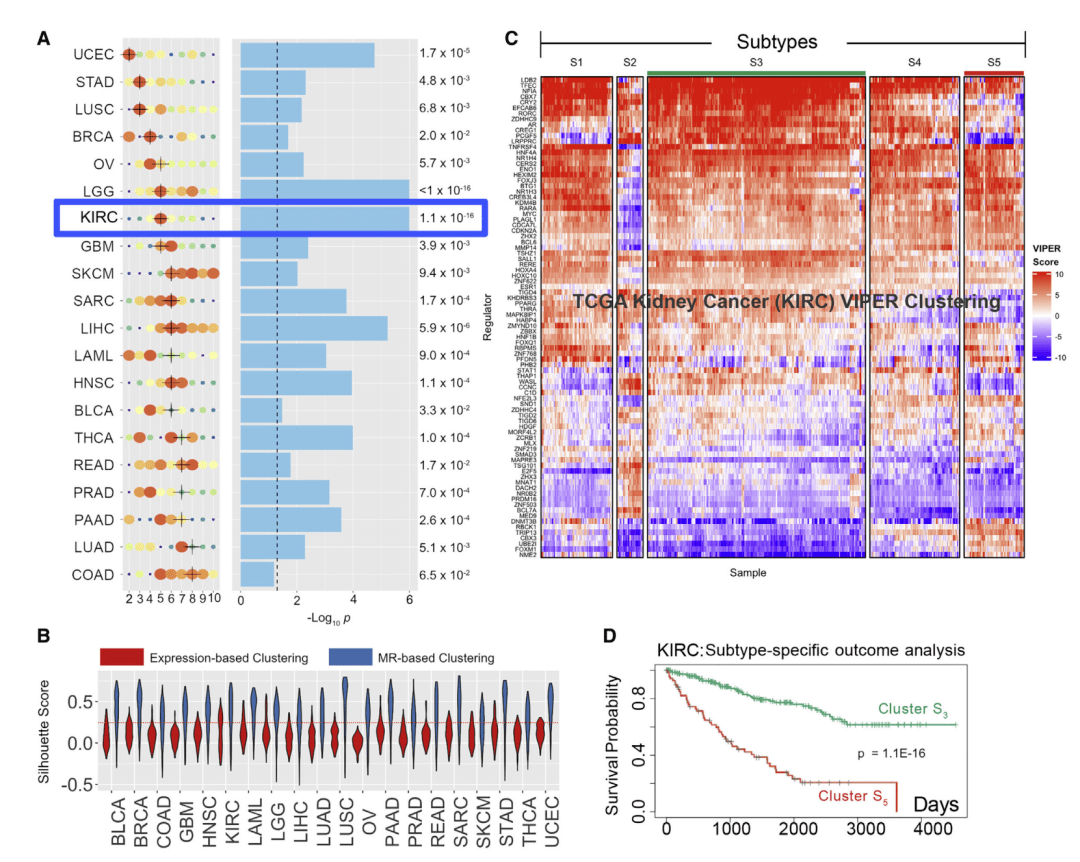
Fig.2
首先,为了确定代表由相同MR蛋白调节的不同转录肿瘤身份的肿瘤亚型,作者根据样本之间的蛋白质活性谱的相似性,在每个蛋白通过其队列特异性综合MOMA评分进行加权,围绕medioids聚类(PAM)进行划分。MOMA从基因表达分析的角度确定了先前具有挑战性的队列中的亚型和差异结果。
上游路径中功能突变较多的蛋白则被认为更可能是肿瘤亚型识别的决定因素,并为聚类解决方案提供更大的权重。在每个队列中,通过使用聚类可靠性评分(CRS)确定最佳聚类数。Fig.2A即展示从最低的子宫体子宫内膜癌(UCEC)到最高的结肠腺癌(COAD)的最佳亚型数(x轴)。并通过Kaplan-Meier分析最佳和最差集群之间生存分离的显著性。
Fig.2B展示了使用相同的方法,在所有20个队列中,基于MR的聚类都优于基于整合表达谱的聚类。Fig.2C、D展示了一个说明性示例,为患者生存率的Cox比例风险分析肾透明细胞癌(KIRC),展示组5(最差)与组3(最佳)的不同结果。
阶段二 | 识别407个影响癌症状态的主要调控基因突变
1
所有亚型候选主调控子的基因组饱和分析
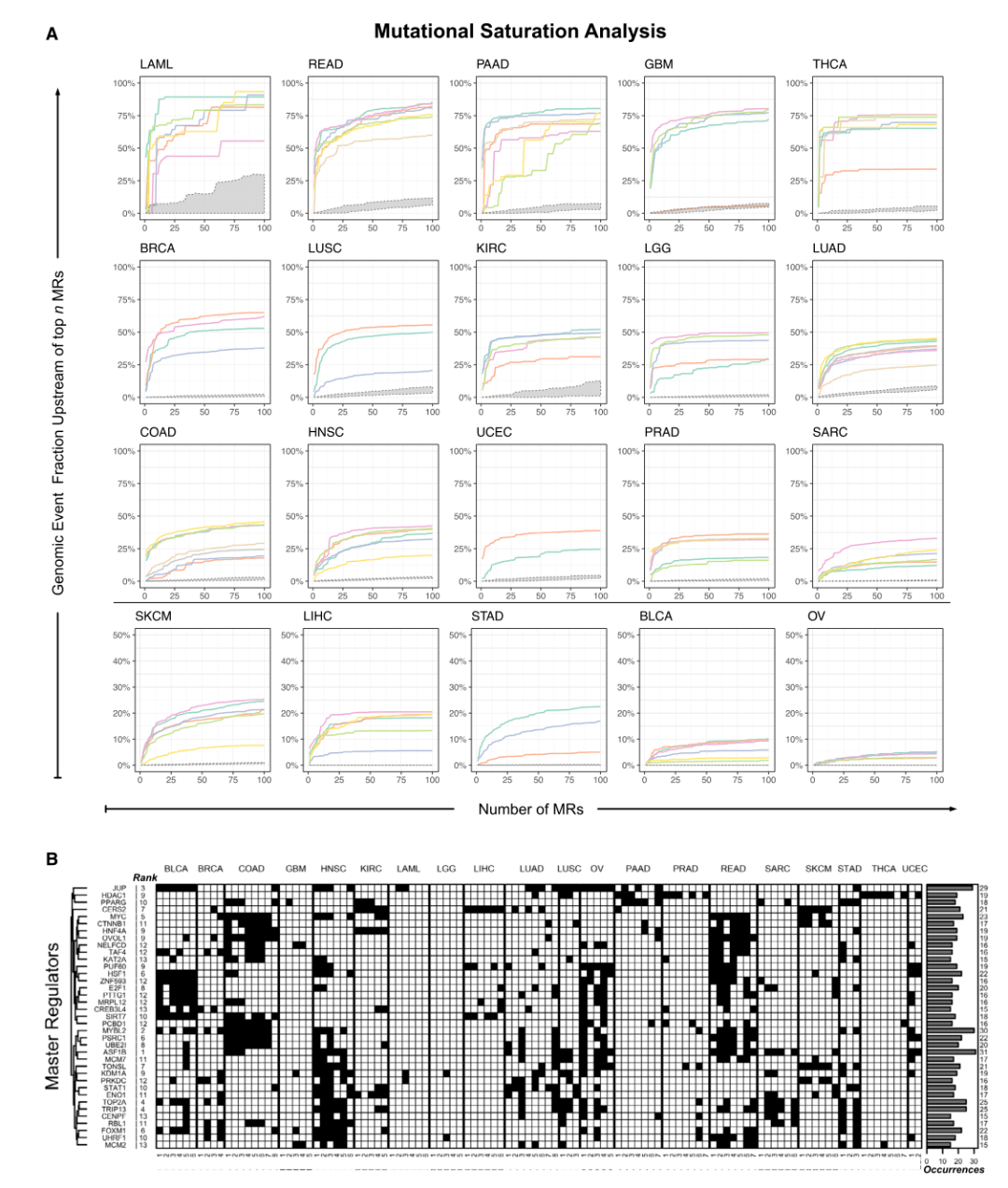
Fig.3
本项研究中,肿瘤检查点为一个具有最小基因库的模块,通过在其上游通路中导入基因组事件来实现肿瘤的转录特性。随后,使用饱和分析将MOMA分析产生的亚型特异性蛋白质的初始排序列表细化为最能说明亚型遗传景观的一小组候选MRs。并进一步将MRs上游相同的扩增子SCNA整合为单个区域事件,并通过GISTIC 2选择通过癌症中重要靶点的基因组进行鉴定,将确定的基因组事件进一步细化这些事件。然后,作者绘制了预测位于前n个候选MRs或其上游的所有此类事件的分数,以样本为基础,对同一亚型中的所有样本进行平均。如Fig.3A中单个曲线显示了每个样本中,由MOMA预测的在每个亚型的顶端MR蛋白,确定的上游功能基因组事件的平均分数。Fig.3B展示了发生在mR15亚型中37例高度复发的
2
COAD中基因组改变失调的肿瘤检查点
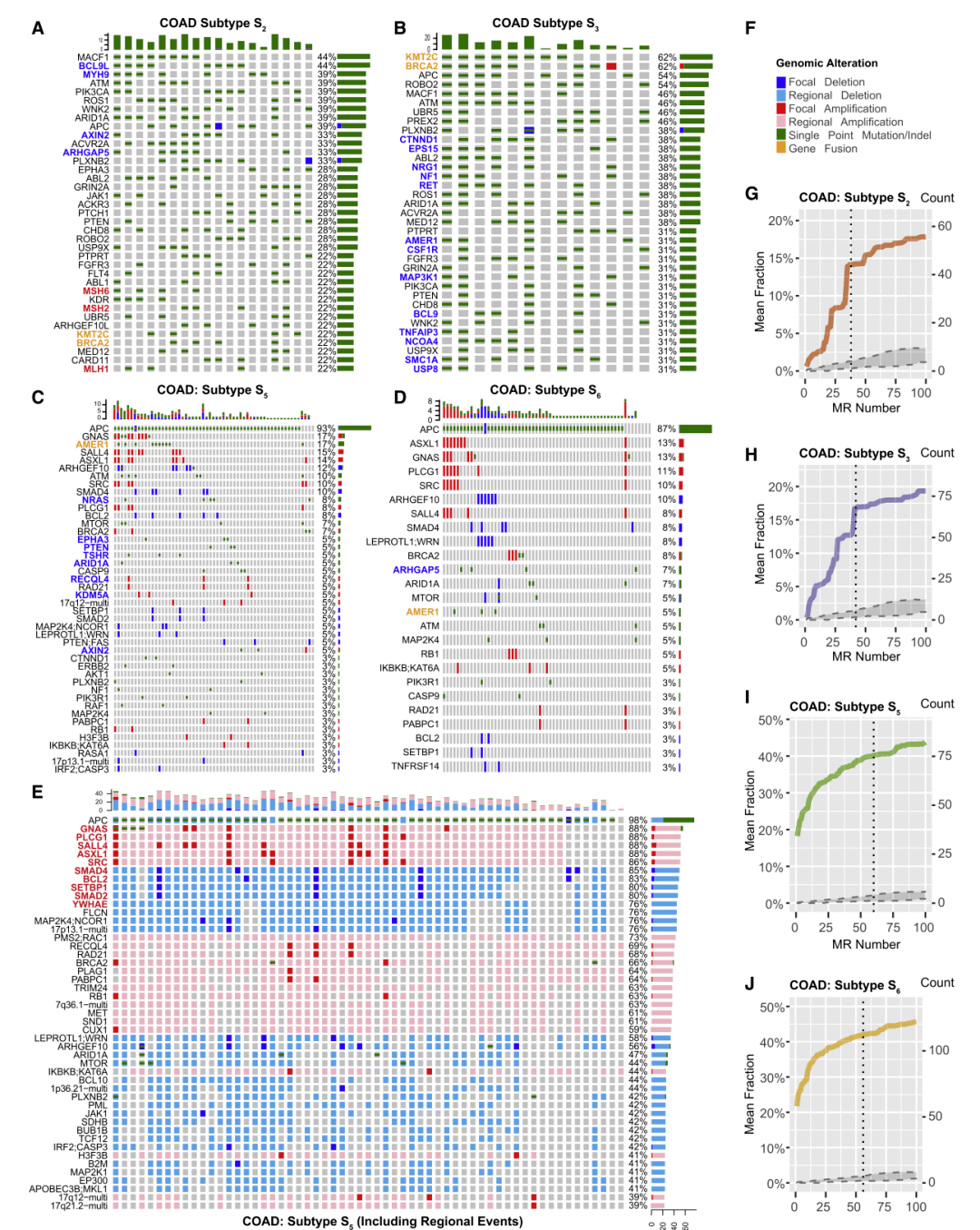
Fig.4
例如,在COAD中,确定了八种亚型。这些亚型的突变情况截然不同。其中,错配修复基因(MSH2、MSH6、a n dMLH1)在50%的S2样本中发生了突变,但在S3样本中没有发生突变。Fig.4A、B和C、D分别展示了COAD中S2/S3(MSIHigh)亚型和S5/S6(MSS)亚型,上游通路的基因组改变。如SBRCA2在S3样本中发生了不成比例的突变,其他几个基因在任一亚型中都发生了唯一或不成比例的突变。
阶段三 | 识别24个保守的主调节块调节肿瘤的特征
1
MRB在癌症中反复激活,并调节已确定的肿瘤特征
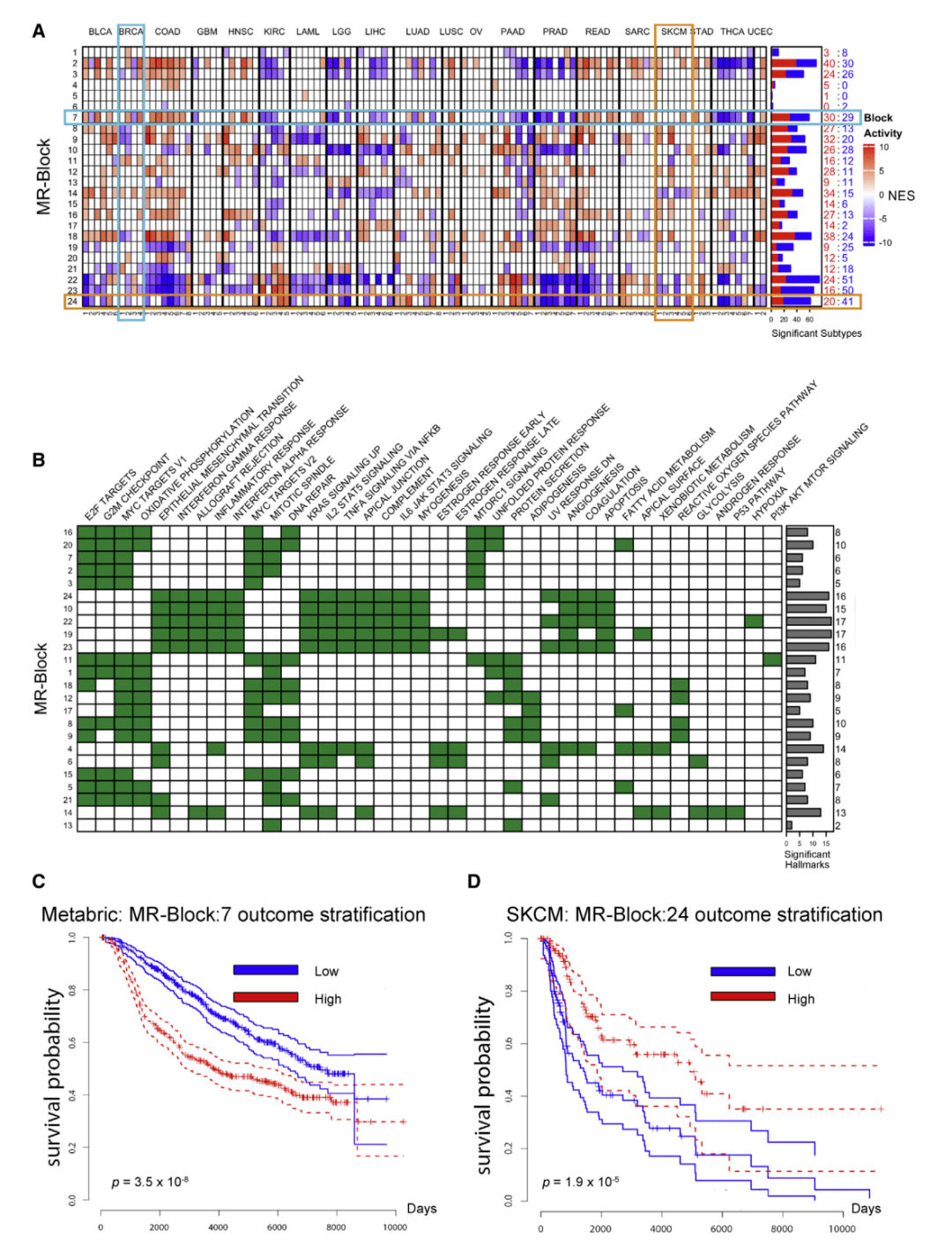
Fig.5
作者测试了亚型特异性肿瘤检查点是否可以分解为更细粒度的MR子模块——在代表胰腺癌核心调控结构的多个亚型中反复出现。通过饱和和递归分析确定的407个MRs,聚类产生24个MRB作为最佳解决方案。因此,Fig.5A展示了每个肿瘤检查点被解构为激活或失活MRB的特定组合,其中MRB活性被计算为其所有MRs的平均活性,并按肿瘤类型分组。Fig.5B展示了单个MRB MRs的转录靶点在统计上显著富集于癌症特征。例如,MRB:7-控制增殖和DNA修复程序和MRB:24-控制炎症和免疫反应程序在不同亚型之间具有不同的活性。以及Fig.5C、D展示了MRB活性在多个数据集中有效地分层结果。与MRB:7相比,MRB:24的活性越高,预后越好,这与其作为炎症和免疫感应标记物的作用一致。
2
MRB预后分析
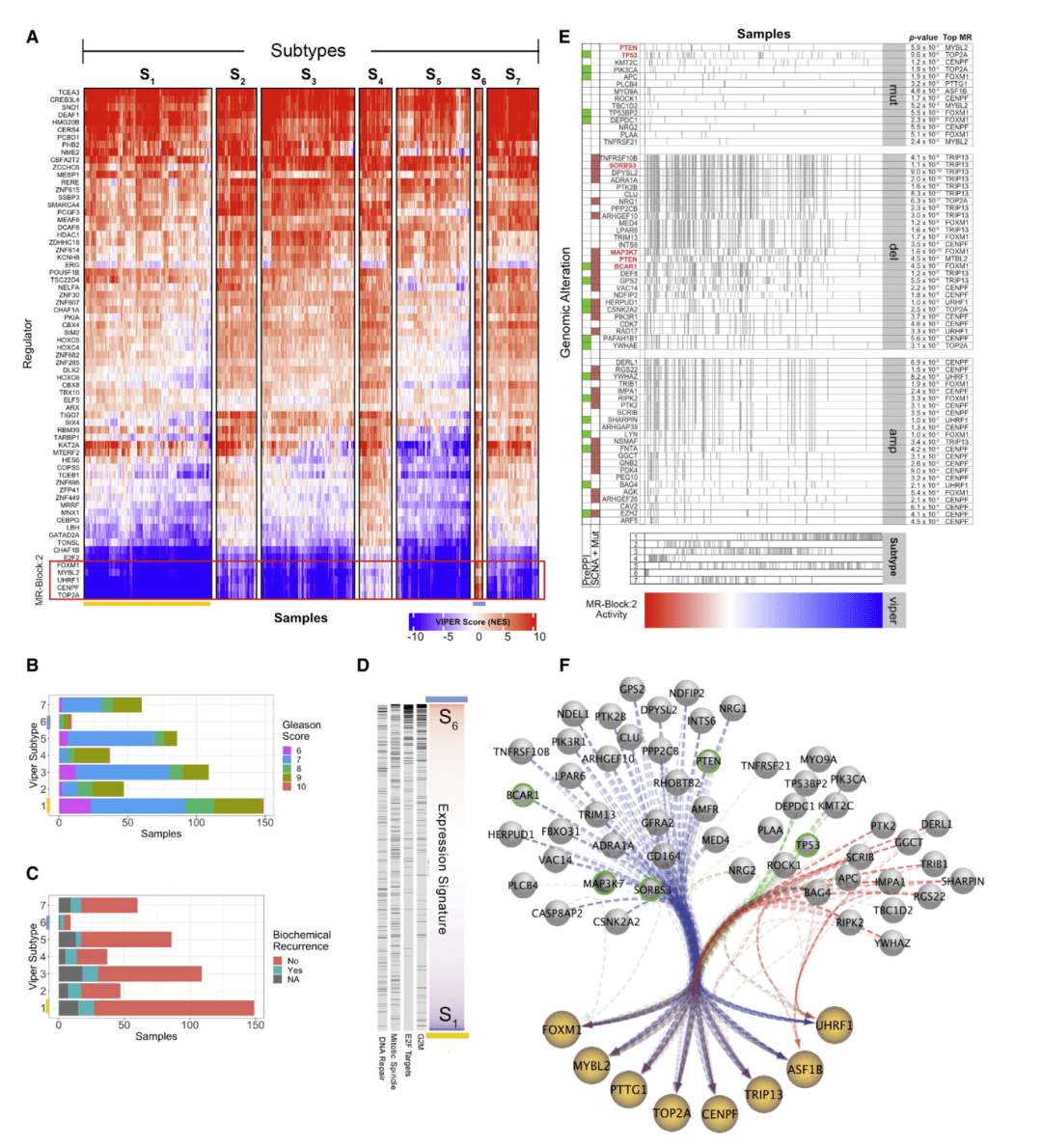
Fig.6
为了评估MRB是否可以对患者的预后进行分层,作者使用Lasso-COX比例风险回归模型,将MRB活动作为预测因素。发现在20个TCGA队列中,16个可以有效分层。并分析代谢型乳腺癌队列加以验证。如Fig.6A展示了通过MOMA确定七种分子上不同的前列腺癌亚型,表现出显著的生存差异,这一点通过Gleason评分和生化复发分析得到证实(Fig.6B、C)。
随后,对MRB中的基因富集,发现S16和S6亚型之间差异表达的2个标志性类别基因(Fig.6D)。并根据所有TCGA队列中MRB:2的统计显著性,对MOMA推断的上游MRB:2变化进行排名。Fig.6E、F展示了选择MRB:2相关性最强的人群。由此说明MRB:2及其上游基因改变驱动最具攻击性的PRAD亚型。
转自:解螺旋- 本文固定链接: https://www.maimengkong.com/kyjc/1174.html
- 转载请注明: : 萌小白 2022年9月7日 于 卖萌控的博客 发表
- 百度已收录
